Oxidace sekundárních alkoholů na ketony
Oxidace sekundárních alkoholů na ketony jsou skupinou organických redoxních reakcí,
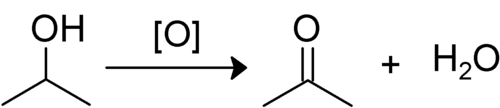
Oxidací sekundárního alkoholu vzniká keton. Odštěpí se přitom hydroxylový vodík a vodík vázaný na uhlík, ke kterému je připojen kyslík. Zbývající kyslík poté vytvoří dvojnou vazbu s uhlíkem, čímž se vytvoří keton R1–COR2. Ketony jsou odolné proti dalším oxidacím, protože by k ním bylo potřebné rozštěpit sousední vazbu C–C, což však mohou zajistit silná oxidační činidla; potom vznikají estery či karboxylové kyseliny.[1]
Spektrum použitelných oxidantů je široké.
Dichroman draselný
Sekundární alkoholy mohou být oxidovány na ketony okyseleným roztokem dichromanu draselného, který je zahříván a refluxován. Oranžovočervený dichromanový ion, Cr2O 2−
7 , se redukuje na zelený Cr3+. Tato reakce byla používána na dokazování přítomnosti alkoholu v dechu.
Chlorchroman pyridinia
Chlorchroman pyridinia (PCC), rozpuštěný v organickém rozpouštědle, přeměňuje sekundární alkoholy na ketony. Jeho reakce jsou vysoce selektivní a nedochází u nich k přeoxidování.
Dessova–Martinova oxidace
Při Dessových–Martinových oxidacích se používá Dessův–Martinův perjodinan.[2]
Reakce probíhají za pokojové teploty, nejobvyklejším rozpouštědlem je dichlormethan. Doba reakce bývá mezi 1,5 a 2 hodinami a poté se produkt odděluje od použitého perjodinanu.[3]
Swernova oxidace
Swernova oxidace spočívá v oxidaci sekundárních alkoholů na ketony oxalylchloridem a dimethylsulfoxidem. Nutná je také přítomnost organické zásady, jako je triethylamin.
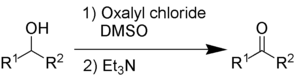
Vedlejšími produkty jsou dimethylsulfid (Me2S), oxid uhelnatý (CO), oxid uhličitý (CO2) a sůl použité zásady – u triethylaminu jde o triethylamoniumchlorid (C6H15NHCl). Dimethylsulfid a oxid uhelnatý jsou toxické, takže se reakce provádějí v digestořích nebo ve venkovním prostředí.
Oppenauerova oxidace
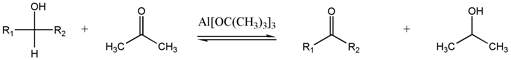
Fétizonova oxidace
Uhličitan stříbrný na křemelině oxiduje alkoholy jednoelektronově, prostřednictvím stříbrných iontů.

Odkazy
Reference
V tomto článku byl použit překlad textu z článku Oxidation of secondary alcohols to ketones na anglické Wikipedii.
- ↑ Burton, George et al. (2000). Salters Advanced Chemistry: Chemical (2nd ed.). Heinemann. ISBN 0-435-63120-9
- ↑ Dess, D. B.; Martin, J. C. Journal of the American Chemical Society 1991, 113, 7277–87
- ↑ J. S. Yadav, et al. "Recyclable 2nd generation ionic liquids as green solvents for the oxidation of alcohols with hypervalent iodine reagents", Tetrahedron, 2004, 60, 2131–35
Související články
Média použitá na této stránce
Description: Reaction scheme of the Swern reaction.
- Author, date of creation: selfmade by ~K, 15 October 2005.
- Source: -
- Copyright: Public domain. (PD)
- Comments: high-resolution b/w PNG; ChemDraw / The GIMP.
Oxidation of propan-2-ol to propanone
Comments
High-resolution transparent .PNG made with ACD/ChemSketch and ISIS/Draw — see WikiProject Chemistry - structure drawing for detailed instructions. Please drop me a note if you need the source file.Autor: Jshen02, Licence: CC0
Silver carbonate on celite oxidizes alcohols through single electron oxidation by the silver cations



