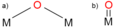
Oxokomplexy kovů

Oxokomplexy kovů jsou komplexní sloučeniny obsahující oxo ligandy, O2−. Tyto ligandy mohou být navázané na jedno i na více kovových center, takže se mohou vyskytovat jako koncové (terminální) i jako můstkové ligandy. Oxo ligandy stabilizují vysoká oxidační čísla kovů.[1]
Komplexy oxo ligandů jsou součástmi některých metaloproteinů, příklady mohou být molybdenové kofaktory a řada enzymů obsahujících železo. Jednou z prvních umělých sloučenin obsahujících oxo ligandy byl železan draselný (K2FeO4), pravděpodobně připravený Georgem Ernstem Stahlem v roce 1702.[2]
Reakce
Olace a acidobazické reakce
Běžnou reakcí oxokomplexů je olace, kdy se v důsledku kondenzace přeměňují nízkomolekulární oxidy na polymery obsahující řetězce typu M-O-M. Olace obvykle začínají deprotonacemi hydroxokomplexů a jsou základem mineralizace a srážení oxidů kovů.
Přesuny kyslíkových atomů
Oxokomplexy kovů jsou meziprodukty řady oxidací katalyzovaných kovy. Přenosy kyslíkových atomů jsou předměty výzkumu v organické chemii a biochemii.[3] Některé tyto komplexy mohou přenášet oxo ligandy na organické substráty; příkladem mohou být enzymy patřící mezi molybdenoxotransferázy.
Při katalytických oxidacích vody jsou oxokomplexy kovů meziprodukty přeměn vody na O2.
Odštěpení vodíkových atomů
Oxokomplexy mohou také štěpit silné vazby C–H, N–H a O–H. Cytochrom P450 obsahuje oxokomplex železa, který je schopný odštěpit vodíky z vazeb C–H.[4]
Molekulové oxidy
K nejdéle známým a nejvíce používaným oxosloučeninám patří oxosloučeniny kovů, jako jsou manganistan draselný (KMnO4) a oxid osmičelý (OsO4).[5] Tyto látky se používají k oxidacím alkenů na vicinální dioly a alkoholů na ketony nebo karboxylové kyseliny.[1] K selektivnějším a/nebo mírnějším oxidačním činidlům patří například chlorchroman pyridinia a dichroman pyridinia.[1] Oxosloučeniny kovů mohou fungovat i jako katalyzátory, například asymetrických oxidací. Využívají se i k aktivacím vazeb C-H, sloužícím k převádění uhlovodíků na alkoholy.[6]

Příklady molekulových oxidů kovů, zleva: vanadylchlorid (d0), oxokarbonyl wolframu (d2), manganistanový anion (d0), [ReO2(pyridin)4]+ (d2), část struktury cytochromu P450 (d4) Ir(O)(mesityl)3 (d4)[7]
Metaloenzymy
Železičité oxosloučeniny

Železičité oxosloučeniny jsou meziprodukty mnoha biologických oxidací:
- Alfa-ketoglutarát dependentní hydroxylázy aktivují O2 oxidační dekarboxylací alfa-ketoglutarátu za vzniku Fe4+=O centers, která hydroxylují uhlovodíkové substráty.[9]
- Enzymy cytocromu P&NBSP450 používají hemový kofaktor k navázání kyslíku na nasyené vazby C–H,[10] epoxidacím alkenů[11][12] a oxidacím aromatických skupin.[13]
- Methanmonooxygenáza oxiduje methan na methanol prostřednictvím přenosu atomu kyslíku z želežičitého meziproduktu ve svém nehemovém diželezovém centru.[14]
Výzkum se zaměřuje na provádění takovýchto reakcí pomocí syntetických katalyzátorů.[6]
Sloučeniny molybdenu a wolframu

Oxo (nebo obdobný sulfido ligand) je velmi rozšířený v chemii molybdenu a wolframu, objevuje se v rudách těchto prvků, v jejich syntetické chemii, a také se podílí na jejich biologických účincích. Za výchozí látky biosyntéz se považují oxometaláty MoO4−2 a WO4−2. Všechny Mo/W enzymy, s výjimkou nitrogenáz, mají na sebe navázanou jednu nebo více molybdopterinových prostetických skupin. Mo/W centra mění svá oxidační čísla z VI na IV a zpět. Přestože jsou mezi těmito enzymy určité rozdíly, tak všechny zprostředkovávají přenosy atomů kyslíku mezi Mo/W centry a substrátem.[15]
Příklady reakcí jsou:
- Sulfitoxidázy: SO3−2 + H2O → SO4−2 + 2 H+ + 2 e−
- DMSO reduktázy: H3CS(O)CH3 (DMSO) + 2 H+ + 2 e− → H3CSCH3 (DMS) + H2O
- aldehydferredoxinoxidoreduktázy: RCHO + H2O → RCO2H + 2 H+ + 2 e−
Biologický význam wolframu je podobný jako u molybdenu.[16]
Triáda titanu
Koncové oxo ligandy jsou vzácné i u prvků triády titanu, obzvláště u zirkonia a hafnia, a nebyly vytvořeny u kovů 3. skupiny (skandia, yttria a lanthanu).[1]
Komplexy uvolňující kyslík
Aktivním místem komplexů uvolňujících kyslík ve fotosystému II je Mn4O5Ca centrum s několika můstkovými oxo ligandy, podílejícími se na oxidaci vody na molekulární kyslík.[17]
Tyto komplexy využívají jako meziprodukty oxidace vody koncové oxo ligandy. Vytvářejí téměř všechen molekulový kyslík v zemské atmosféře.

Oxo zeď
Jako „oxo zeď“ se označuje teorie používaná k vysvětlení nepřítomnosti oktaedrických symetrií u kovových center komplexů s koncovými oxo ligandy a s více než 5 d elektrony.[18][19]
Oxosloučeniny ve skupinách vanadu až železa (skupinách 3–8) jsou početné, zatímco koncové oxosloučeniny kovů skupin kobaltu až zinku (9–12) jsou vzácné; podobně je tomu i u jiných sloučenin s násobnými vazbami kov–ligand. Oznámené výjimky z tohoto pravidla[20][21][22] byly vyvráceny.[23][24][25]
Komplex iridia Ir(O)(mesityl)3 může vypadat jako výjimka z oxo zdi, kterou ovšem není, protože komplex není oktaedrický.[7]
Trigonální symetrie způsobuje přeuspořádání d orbitalů kovů pod degenerované π* molekulové orbitaly. U komplexů se třemi osami symetrie mohou existovat vícenásobné vazby obsahující až 7 d elektronů.[18]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Transition metal oxo complex na anglické Wikipedii.
- ↑ a b c d Nugent, W. A., Mayer, J. M. "Metal-Ligand Multiple Bonds." John Wiley & Sons, New York, 1988.
- ↑ Lionel Delaude; Pierre Laszlo. A Novel Oxidizing Reagent Based on Potassium Ferrate(VI)1. The Journal of Organic Chemistry. 1996, s. 6360–6370. Dostupné online. ISSN 0022-3263. DOI 10.1021/jo960633p. PMID 11667478.
- ↑ HOLM, R. H. Metal-centered oxygen atom transfer reactions. Chemical Reviews. 1987, s. 1401–1449. DOI 10.1021/cr00082a005. (anglicky)
- ↑ Bernard Meunier; Samuël P. de Visser; Sason Shaik. Mechanism of Oxidation Reactions Catalyzed by Cytochrome P450 Enzymes. Chemical Reviews. 2004, s. 3947–3980. ISSN 0009-2665. DOI 10.1021/cr020443g. PMID 15352783.
- ↑ G. Du; M. M. Abu-Omar. Oxo and Imido Complexes of Rhenium and Molybdenum in Catalytic Reductions. Current Organic Chemistry. 2008, s. 1185–1198. DOI 10.2174/138527208785740238.
- ↑ a b A. Gunay; K. H. Theopold. C-H Bond Activations by Metal Oxo Compounds. Chemical Reviews. 2010, s. 1060–1081. DOI 10.1021/cr900269x. PMID 20143877.
- ↑ a b Robyn S. Hay-Motherwell; Geoffrey Wilkinson; Bilquis Hussain-Bates; Michael B. Hursthouse. Synthesis and X-ray Crystal Structure of Oxotrimesityl-Iridium(V). Polyhedron. 1993, s. 2009–2012. DOI 10.1016/S0277-5387(00)81474-6.
- ↑ Xiongyi Huang; John T. Groves. Beyond Ferryl‑Mediated Hydroxylation: 40 Years of the rebound mechanism and C–H activation. Journal of Biological Inorganic Chemistry. 2017, s. 185–207. DOI 10.1007/s00775-016-1414-3. PMID 27909920.
- ↑ R. P. Hausinger. Fe(II)/α-Ketoglutarate-Dependent Hydroxylases and Related Enzymes. Critical Reviews in Biochemistry and Molecular Biology. 2004, s. 21–68. DOI 10.1080/10409230490440541. PMID 15121720.
- ↑ Paul R. Ortiz de Montellano. Hydrocarbon Hydroxylation by Cytochrome P450 Enzymes. Chemical Reviews. 2010, s. 932–948. ISSN 0009-2665. DOI 10.1021/cr9002193. PMID 19769330.
- ↑ M. J. Coon. Epoxidation of olefins by cytochrome P450: Evidence from site-specific mutagenesis for hydroperoxo-iron as an electrophilic oxidant. Proceedings of the National Academy of Sciences. 1998-01-20, s. 3555–3560. DOI 10.1073/pnas.95.7.3555. PMID 9520404. Bibcode 1998PNAS...95.3555V.
- ↑ Edgardo T. Farinas; Miguel Alcalde; Frances Arnold. Alkene epoxidation catalyzed by cytochrome P450 BM-3 139-3. Tetrahedron. 2004, s. 525–528. ISSN 0040-4020. DOI 10.1016/j.tet.2003.10.099.
- ↑ Kenneth Korzekwa; William Trager; Martin Gouterman; Dale Spangler; Gilda Loew. Cytochrome P450 mediated aromatic oxidation: a theoretical study. Journal of the American Chemical Society. 1985, s. 4273–4279. ISSN 0002-7863. DOI 10.1021/ja00300a033.
- ↑ T. C. Brunold. Synthetic Iron-Oxo 'Diamond Core' Mimics Structure of Key Intermediate in Methane Monooxygenase Catalytic Cycle. Proceedings of the National Academy of Sciences of the United States of America. 2007, s. 20641–20642. DOI 10.1073/pnas.0710734105. PMID 18093936. Bibcode 2007PNAS..10420641B.
- ↑ G. Schwarz; R. R. Mendel; M. W. Ribbe. Molybdenum Cofactors, Enzymes and Pathways. Nature. 2009, s. 839–847. DOI 10.1038/nature08302. PMID 19675644. Bibcode 2009Natur.460..839S.
- ↑ S. Mukund; M. W. W. Adams. Molybdenum and Vanadium Do Not Replace Tungsten in the Catalytically Active Forms of the Three Tungstoenzymes in the Hyperthermophilic Archaeon Pyrococcus furiosus. Journal of Bacteriology. 1996, s. 163–167. DOI 10.1128/jb.178.1.163-167.1996. PMID 8550411.
- ↑ a b Yasufumi Umena; Keisuke Kawakami; Jian-Ren Shen; Nobuo Kamiya. Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 Å. Nature. 2011, s. 55–60. Dostupné online. ISSN 0028-0836. DOI 10.1038/nature09913. PMID 21499260. Bibcode 2011Natur.473...55U.
- ↑ a b Jay R. Winkler; Harry B. Gray. Molecular Electronic Structures of Transition Metal Complexes I. Příprava vydání David Michael P. Mingos, Peter Day, Jens Peder Dahl. [s.l.]: Springer Nature, 2012. Dostupné online. ISBN 978-3-642-27369-8. DOI 10.1007/430_2011_55. Kapitola Electronic Structures of Oxo-Metal Ions, s. 17–28.
- ↑ Virginia A. Larson; Beatrice Battistella; Kallol Ray; Nicolai Lehnert; Wonwoo Nam. Iron and manganese oxo complexes, oxo wall and beyond. Nature Reviews Chemistry. 2020, s. 404–419. DOI 10.1038/s41570-020-0197-9.
- ↑ ANDERSON, Travis M.; NEIWERT, Wade A.; KIRK, Martin L.; PICCOLI, Paula M. B.; SCHULTZ, Arthur J.; KOETZLE, Thomas F.; MUSAEV, Djamaladdin G. A Late-Transition Metal Oxo Complex: K7Na9[O=PtIV(H2O)L2], L = [PW9O34]9-. Science. 2004-12-17, s. 2074–2077. Dostupné online. ISSN 0036-8075. DOI 10.1126/science.1104696. PMID 15564312. (anglicky)
- ↑ ANDERSON, Travis M.; CAO, Rui; SLONKINA, Elena; HEDMAN, Britt; HODGSON, Keith O.; HARDCASTLE, Kenneth I.; NEIWERT, Wade A. A Palladium-Oxo Complex. Stabilization of This Proposed Catalytic Intermediate by an Encapsulating Polytungstate Ligand. Journal of the American Chemical Society. 2005-08-01, s. 11948–11949. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja054131h. PMID 16117527. (anglicky)
- ↑ CAO, Rui; ANDERSON, Travis M.; PICCOLI, Paula M. B.; SCHULTZ, Arthur J.; KOETZLE, Thomas F.; GELETII, Yurii V.; SLONKINA, Elena. Terminal Gold-Oxo Complexes. Journal of the American Chemical Society. 2007-09-01, s. 11118–11133. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja072456n. PMID 17711276. (anglicky)
- ↑ O’HALLORAN, Kevin P.; ZHAO, Chongchao; ANDO, Nicole S.; SCHULTZ, Arthur J.; KOETZLE, Thomas F.; PICCOLI, Paula M. B.; HEDMAN, Britt. Revisiting the Polyoxometalate-Based Late-Transition-Metal-Oxo Complexes: The "Oxo Wall" Stands. Inorganic Chemistry. 2012, s. 7025–7031. DOI 10.1021/ic2008914. PMID 22694272. (anglicky)
- ↑ RITTER, Stephen K. Metal-Oxo Papers Retracted [online]. June 12, 2012 [cit. 2021-05-15]. Dostupné online. (anglicky)
- ↑ HADLINGTON2012-06-14T00:00:00+01:00, Simon. Oxo wall still stands as inorganic papers retracted [online]. [cit. 2021-05-15]. Dostupné online. (anglicky)
Související články
- Násobná vazba kov–ligand
- Oxidy
- Polyoxometaláty
- Metaláty
- Oxofilita
- Komplexy přechodných kovů s dikyslíkem
Média použitá na této stránce
Autor: Pwnsey, Licence: CC BY-SA 3.0
Crystal structure of the oxygen evolving complex (OEC) of Cytochrome P450 at 1.9 Angstrom resolution. This is the highest resolution structure of the OEC as of 2016.
Autor: Andrew Murkin, Licence: CC BY-SA 4.0
Oxygen rebound mechanism used by cytochrome P450 enzymes for oxidation of aliphatic compounds to alcohols
Shows bridging and terminal oxo ligands.