PETáza
PETázy jsou enzymy, patřící mezi hydrolázy a podrobněji do esteráz, které katalyzují hydrolýzu polyethylentereftalátu (PET) na monomer v podobě kyseliny 2-hydroxyethyltereftalové (MHET). Souhrnná rovnice (kde n je počet monomerů v polymerovém řetězci), vypadá takto:[1]
- (ethylentereftalát)n + H2O → (ethylentereftalát)n-1 + MHET
Malá množství PET se rozkládají na bis(2-hydroxyethyl)tereftalát (BHET)
PETázy mohou také štěpit PEF (polyethylen-2,5-furandikarboxylát), který je biologicky odvoditelný od PET, na obdobný mono-2-hydroxyethylfuranoát (MHEF). PETázy nekatalyzují hydrolýzy alifatických polyesterů, jako jsou polybutylensukcinát a kyselina polymléčná.[2]
Neenzymatický přirozený rozklad PET může trvat stovky let, ale PETázy jej rozloží za několik dnů.[3]
Historie
První PETáza byla objevena v roce 2016 u kmenu 201-F6 bakterie Ideonella sakaiensis získaného v Japonsku z kalů nedaleko místa, kde byly recyklovány PET lahve.[1][4] Následně byly nalezeny další hydrolázy rozkládající PET,[2] patřící do několika skupin, například mezi lipázy, esterázy a kutinázy.[5] Objevy enzymů rozkládajících polyestery byly učiněny již v letech 1975 (šlo o α-chymotrypsin)[6] a 1977 (v tomto případě se jednalo o lipázu).[7]
PET se začal ve větším rozsahu používat v 70. letech 20. století, PETázy u bakterií byly ale objeveny mnohem později.[2] PETázy mohou mít souvislost s rozkládáním voskovitých vrstev na rostlinách.[8]
Struktura
K dubnu 2019 bylo popsáno 17 trojrozměrných krystalových struktur PETáz: 6QGC, 6ILX, 6ILW, 5YFE, 6EQD, 6EQE, 6EQF, 6EQG, 6EQH, 6ANE, 5XJH, 5YNS, 5XFY, 5XFZ, 5XG0, 5XH2 a 5XH3.
PETázy mají podobné vlastnosti jako lipázy a kutinázy, stejně jako ony patří mezi α/β-hydrolázy; jejich aktivní místa jsou ale otevřenější než u kutináz.[2] PETáza bakterie Ideonella sakaiensis se podle databáze Pfam podobá dienlaktonhydroláze, podle ESTHER patří do skupiny polyesteráz-lipáz-kutináz.
Je známo 69 PETázových enzymů, vyskytujících se u různých skupin organismů; tyto enzymy lze rozdělit do dvou skupin, na typy I a II. K typu I se řadí 57 enzymů a zbylých 12, včetně PETázy u Ideonella sakaiensis, patří do typu II. Všechny popsané PETázy mají v aktivní oblasti stejnou trojici aminokyselin, což naznačuje, že katalytický mechanismus je u všech stejný.[9]
Mutace
V roce 2018 byla objevena mutace původní PETázy, která rozkládá PET výrazně rychleji; ve stejné studii bylo také zjištěno, že PETázy mohou štěpit polyethylen-furan-2,5-dikarboxylát (PEF).[2][10]
Další rozklad u I. sakaiensis

U I. sakaiensis je vzniklý MHET působením MHETázy dále rozkládán na kyselinu tereftalovou a ethylenglykol.[1][12]
Uměle vytvořené proteiny, které spojují MHETázu a PETázu, mají vyšší účinnost než podobné směsi volných enzymů.[13]
Reference
V tomto článku byl použit překlad textu z článku PETase na anglické Wikipedii.
- ↑ a b c S. Yoshida, K. Hiraga, T. Takehana, I. Taniguchi, H. Yamaji, Y. Maeda, K, Toyohara, K. Miyamoto, Y. Kimura, K. Oda. A bacterium that degrades and assimilates poly(ethylene terephthalate). Science. 2016, s. 1196–1199. DOI 10.1126/science.aad6359. PMID 26965627.
- ↑ a b c d e H. P. Austin, M. D. Allen, B. S. Donohoe, N. A. Rorrer, F. L. Kearns, R. L. Silveira, B. C. Pollard, G. Dominick, R. Duman, K. El Omari, V. Mykhaylyk, A. Wagner, W. E. Michener, A. Amore, M. S. Skaf, M. F. Crowley, A. W. Thorne, C. W. Johnson, H. L. Woodcock, J. E. McGeehan, G. T. Beckham. Characterization and engineering of a plastic-degrading aromatic polyesterase. Proceedings of the National Academy of Sciences of the United States of America. 2018, s. E4350–E4357. DOI 10.1073/pnas.1718804115. PMID 29666242.
- ↑ Peter Dockrill. Scientists Have Accidentally Created a Mutant Enzyme That Eats Plastic Waste. [s.l.]: ScienceAlert Dostupné online.
- ↑ S. Tanasupawat; T. Takehana; S. Yoshida; K. Hiraga; K. Oda. Ideonella sakaiensis sp. nov., isolated from a microbial consortium that degrades poly(ethylene terephthalate). International Journal of Systematic and Evolutionary Microbiology. 2016, s. 2813–2818. DOI 10.1099/ijsem.0.001058. PMID 27045688.
- ↑ X. Han, W. Liu, J. W. Huang, J. Ma, Y. Zheng, T. P. Ko, L. Xu, Y. S. Cheng, C. C. Chen, R. T. Guo. Structural insight into catalytic mechanism of PET hydrolase. Nature Communications. 2017, s. 2106. DOI 10.1038/s41467-017-02255-z. PMID 29235460.
- ↑ Iwao Tabushi; Hidenori Yamada; Hidetaka Matsuzaki; Junji Furukawa. Polyester readily hydrolyzable by chymotrypsin. Journal of Polymer Science: Polymer Letters Edition. 1975, s. 447–450. DOI 10.1002/pol.1975.130130801.
- ↑ Y. Tokiwa; T. Suzuki. Hydrolysis of polyesters by lipases. Nature. 1975, s. 76–78. DOI 10.1038/270076a0. PMID 927523.
- ↑ Lab 'Accident' Becomes Mutant Enzyme That Devours Plastic. [s.l.]: Live Science Dostupné online.
- ↑ a b S. Joo, I. J. Cho, H. Seo, H. F. Son, H. Y. Sagong, T. J. Shin, S. Y. Choi, S. Y. Lee, K. J. Kim. Structural insight into molecular mechanism of poly(ethylene terephthalate) degradation. Nature Communications. 2018, s. 382. DOI 10.1038/s41467-018-02881-1. PMID 29374183.
- ↑ Damian Carrington. New super-enzyme eats plastic bottles six times faster. [s.l.]: The Guardian Dostupné online.
- ↑ Allison Chan. The Future of Bacteria Cleaning Our Plastic Waste [online]. 2016. Dostupné online.
- ↑ Discovery of a Bacterium that Degrades and Assimilates Poly(ethylene terephthalate) could Serve as a Degradation and/or Fermentation Platform for Biological Recycling of PET Waste Products. [s.l.]: [s.n.], 2016-03-30. Dostupné online.
- ↑ B. C. Knott, E. Erickson, M. D. Allen, J. E. Gado, R. Graham, F. L. Kearns, I. Pardo, E. Topuzlu, J. J. Anderson, H. P. Austin, G. Dominick, C. W. Johnson, N. A. Rorrer, C. J. Szostkiewicz, V. Copié, C. M. Payne, H. L. Woodcock, B. S. Donohoe, G. T. Beckham, J. E. McGeehan. Characterization and engineering of a two-enzyme system for plastics depolymerization. Proceedings of the National Academy of Sciences of the United States of America. 2020, s. 25476–25485. DOI 10.1073/pnas.2006753117. PMID 32989159.
Média použitá na této stránce
Autor: Keministi, Licence: CC0
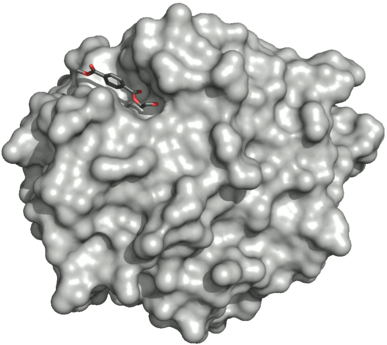
1.3 Å crystal structure of a PETase R103G/S131A mutant enzyme in complex with HEMT from Ideonella sakaiensis strain 201-F6. Released: 2017-12-20. PDBID: 5XH3.
Surface of the PETase with HEMT (1-(2-hydroxyethyl) 4-methyl terephthalate) bound to its catalytic center.
Organism(s): Ideonella sakaiensis (strain 201-F6) Expression System: Escherichia coli BL21(DE3)
This picture is made with PyMOL version 2.0.4 and is based on the following study:
Han, Xu; Liu, Weidong; Huang, Jian-Wen; Ma, Jiantao; Zheng, Yingying; Ko, Tzu-Ping; Xu, Limin; Cheng, Ya-Shan; Chen, Chun-Chi (2017-12-13). "Structural insight into catalytic mechanism of PET hydrolase". Nature Communications. 8. doi:10.1038/s41467-017-02255-z. ISSN 2041-1723. PMC 5727383. PMID 29235460.Autor: Meganlilyanderson, Licence: CC BY-SA 4.0
Plastic breakdown by PETase
Autor: Meganlilyanderson, Licence: CC BY-SA 4.0
Ribbon diagram of PETase with three residues Ser160, Asp206, and His237. The catalytic triad is represented by cyan-colored sticks. The active site is shown in orange to represent stimulation by a 2-HE(MHET)4 molecule.
![Diagram PETázy se třemi zbytky Ser160, Asp206 a His237. Katalytická triáda je znázorněna světle modře. Aktivní místo je znázorněno oranžově, což naznačuje stimulaci molekulou 2-HE(MHET)4.[9]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/db/PETase_active_site.png/739px-PETase_active_site.png)


