Palladacyklické sloučeniny
Palladacyklické sloučeniny jsou metalocyklické sloučeniny obsahující vazby mezi atomy uhlíku a palladia. Vyskytují se jako meziprodukty reakcí katalyzovaných nebo řízených palladiem. Palladacyklické sloučeniny se zkoumají jako prekatalyzátory reakcí v homogenní katalýze a organické syntéze.
Historie
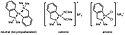
V 60. letech 20. století popsali Arthur C. Cope a Robert W. Siekman cyklopaladační reakce azobenzenů s chloridem palladnatým.[1] Využitelnost palladacyklů jako katalyzátorů se zvýšila objevem Herrmannova katalyzátoru v 90. letech. Deriváty tris(o-tolyl)fosfinu lze použít v Heckových reakcích.[2]

Rozdělení
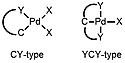
Palladacyklické sloučeniny lze rozdělit do dvou skupin: na donory čtyř elektronů a donory šesti elektronů.

Neutrální, kationtové a aniontové palladacykly
Palladacyklické komplexy mohou být neutrální, kationtové, nebo aniontové. Neutrální mohou být, v závislosti na vlastnostech ligandů, monomerní, dimerní, či bis-cyklopalladované.

Velikosti kruhů
Jsou popsány palladacyklické sloučeniny, jejichž kruhy obsahují od 3 do 10 atomů, běžněji se ale využívají pouze 5- a šestičlenné kruhy. Palladacykly s 3, 4, nebo více než 6 atomy bývají, v důsledku kruhového napětí, nestálé.

Donorové skupiny
Palladacyklické sloučeniny lze rozdělit i podle druhu donorových atomů; například Herrmannův katalyzátor patří mezi fosfinové palladacykly. Dalšími druhy jsou palladacykly fosfitové, iminové, oximové a CS-/CO-palladacykly. Palladacykly odvozené od 2-aminobifenylu mohou být zařazeny do křížových párovacích reakcí.
Příprava
Palladacyklické sloučeniny lze připravit několika způsoby. Jedním z nich je aktivace vazeb C–H.[3]
Cyklopaladace aromatických sloučenin pravděpodobně probíhají jako elektrofilní aromatické substituce.[4] Použít se dají i oxidační adice arylhalogenidů;[5] tento postup je však omezen horší dostupností arylhalogenidů.

Účinné jsou rovněž transmetalace[6] a nukleopalladace.[7]
Použití
Prekatalyzátory
Palladacyklické sloučeniny se používají jako prekatalyzátory, nejčastěji v redukčních eliminacích, kde se mění palladnaté (Pt2+) komplexy na aktivní Pd0. U 2-aminobifenylových palladacycklů se vytváří kineticky aktivní 12elektronový komplex Pd0, což umožňuje další oxidačně adiční reakce.[8]
Za účelem lepšího popsání elektronových a sterických efektů byly připraveny různé 2-aminobifenylové palladacykly.

S palladacyklickými prekatalyzátory lze dosáhnout vysokých reaktivit a selektivit u Heckových a mnoha křížově párovacích reakcí, jako jsou Suzukiova,[9] Sonogaširova,[10] Stilleova[11] a Buchwaldova–Hartwigova.[12]
Palladacykly byly využity i při několika totálních syntézách.[13][14]

Další využití
Mimo katalýzy mohou být palladacyklické sloučeniny využití také v lékařství, například cisplatina se používá jako protinádorové léčivo.[15]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Palladacycle na anglické Wikipedii.
- ↑ Arthur C. Cope; Robert W. Siekman. Formation of Covalent Bonds from Platinum or Palladium to Carbon by Direct Substitution. Journal of the American Chemical Society. 1965, s. 3272–3273. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja01092a063.
- ↑ Wolfgang A. Herrmann; Christoph Brossmer; Claus-Peter Reisinger; Thomas H. Riermeier; Karl Öfele; Matthias Beller. Palladacycles: Efficient New Catalysts for the Heck Vinylation of Aryl Halides. Chemistry - A European Journal. 1997, s. 1357–1364. DOI 10.1002/chem.19970030823.
- ↑ S. Trofimenko. Cyclopalladation reaction. Inorganic Chemistry. 1973, s. 1215–1221. Dostupné online. ISSN 0020-1669. DOI 10.1021/ic50124a001.
- ↑ George W. Parshall. Intramolecular aromatic substitution in transition metal complexes. Accounts of Chemical Research. 1970, s. 139–144. Dostupné online. ISSN 0001-4842. DOI 10.1021/ar50028a004.
- ↑ Gema Rodríguez; Martin Albrecht; Jeroen Schoenmaker; Alan Ford; Martin Lutz; Anthony L. Spek; Gerard van Koten. Bifunctional Pincer-type Organometallics as Substrates for Organic Transformations and as Novel Building Blocks for Polymetallic Materials. Journal of the American Chemical Society. 2002, s. 5127–5138. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja0177657. PMID 11982378.
- ↑ David M. Grove; Gerard van Koten; Jaap N. Louwen; Jan G. Noltes; Anthony L. Spek; Henk J. C. Ubbels. Trans-2,6-bis[(dimethylamino)methyl]phenyl-N,N',C complexes of palladium(II) and platinum(II). Crystal structure of [PtI[MeC6H3(CH2NMe2)2-o,o']]BF4: a cyclohexadienyl carbonium ion with a .sigma.-bonded metal substituent. Journal of the American Chemical Society. 1982, s. 6609–6616. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja00388a02.
- ↑ Robert A. Holton; Richard A. Kjonaas. Carbopalladation-depalladation of allylic amines and sulfides. Journal of the American Chemical Society. 1977, s. 4177–4179. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja00454a057.
- ↑ Alexandre Bruneaun; Maxime Roche; Mouad Alami; Samir Messaoudi. 2-Aminobiphenyl Palladacycles: The Most Powerful Precatalysts in C–C and C–Heteroatom Cross-Couplings. ACS Catalysis. 2015-02-06, s. 1386–1396. Dostupné online. ISSN 2155-5435. DOI 10.1021/cs502011x.
- ↑ Ting-Yi Lu; Cuihua Xue; Fen-Tair Luo. Palladium-catalyzed cross-coupling reaction of aryldioxaborolane with 2-bromo-N,N-dimethylacetamide. Tetrahedron Letters. 2003, s. 1587–1590. Dostupné online. DOI 10.1016/S0040-4039(03)00066-2.
- ↑ Virginie Brun; Michel Legraverend; David S. Grierson. Traceless solid-phase synthesis of 2,6,9-trisubstituted purines from resin bound 6-thiopurines. Tetrahedron. 2002, s. 7911–7923. Dostupné online. DOI 10.1016/S0040-4020(02)00905-5.
- ↑ Peter Prinz; Annegret Lansky; Burkhard Knieriem; Armin de Meijere; Thomas Haumann; Roland Boese; Matthias Noltemeyer. Palladium-Catalyzed Sixfold Alkenylation of Hexabromobenzene: An Interesting Case of Self-Organization. Angewandte Chemie International Edition in English. 1997-07-04, s. 1289–1292. Dostupné online. ISSN 0570-0833. DOI 10.1002/anie.199712891.
- ↑ Danilo Zim; Stephen L. Buchwald. An Air and Thermally Stable One- Component Catalyst for the Amination of Aryl Chlorides. Organic Letters. 2003, s. 2413–2415. Dostupné online. ISSN 1523-7060. DOI 10.1021/ol034561h. PMID 12841743.
- ↑ Robert A. Holton. Prostaglandin synthesis via carbopalladation. Journal of the American Chemical Society. 1977, s. 8083–8085. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja00466a069.
- ↑ Armin de Meijere; Michael Schelper; Mario Knoke; Baris Yucel; Hans Wolf Sünnemann; René Peter Scheurich; Lars Arve. Palladium-catalyzed cross-coupling reactions and electrocyclizations—efficient combinations for new cascade reactions. Journal of Organometallic Chemistry. 2003-12-07, s. 249–255. Dostupné online. ISSN 0022-328X. DOI 10.1016/j.jorganchem.2003.07.007.
- ↑ Anant Kapdi; Debabrata Maiti. Palladacycles : catalysis and beyond. [s.l.]: [s.n.], 2019. Dostupné online. ISBN 978-0-12-816516-4.
Literatura
- BELETSKAYA, Irina P.; CHEPRAKOV, Andrei V. Palladacycles in catalysis – a critical survey. Journal of Organometallic Chemistry. November 2004, s. 4055–4082. Dostupné online. DOI 10.1016/j.jorganchem.2004.07.054. (anglicky)
- DUPONT, Jairton; CONSORTI, Crestina S.; SPENCER, John. The Potential of Palladacycles: More Than Just Precatalysts. Chemical Reviews. 2005-06-01, s. 2527–2572. Dostupné online. ISSN 0009-2665. DOI 10.1021/cr030681r. PMID 15941221. (anglicky)
- BRUNEAU, Alexandre; ROCHE, Maxime; ALAMI, Mouad; MESSAOUDI, Samir. 2-Aminobiphenyl Palladacycles: The "Most Powerful" Precatalysts in C–C and C–Heteroatom Cross-Couplings. ACS Catalysis. 2015-02-06, s. 1386–1396. Dostupné online. ISSN 2155-5435. DOI 10.1021/cs502011x. (anglicky)
Média použitá na této stránce
Autor: Nihq96, Licence: CC BY-SA 4.0
The first palladacycle from aromatic azo compounds and the Herrmann’s catalyst.
Autor: Nihq96, Licence: CC BY-SA 4.0
Examples of neutral, cationic and anionic palladacycles.
Autor: Nihq96, Licence: CC BY-SA 4.0
Preparation of palladacycles via C-H activation and oxidative addition.
Autor: Nihq96, Licence: CC BY-SA 4.0
Activation of Buchwald palladacycle pre-catalysts.
Autor: Nihq96, Licence: CC BY-SA 4.0
Examples of palladacycles with various ring-sizes.
Autor: Nihq96, Licence: CC BY-SA 4.0
Palladacycles as intermediate and pre-catalyst in total synthesis