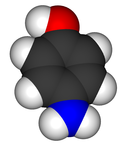
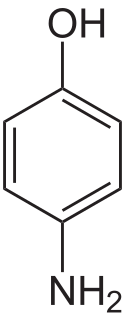
4-aminofenol
| 4-aminofenol | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 4-aminofenol |
| Ostatní názvy | p-aminofenol, para-aminofenol |
| Sumární vzorec | C6H7NO |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 123-30-8 |
| EC-no (EINECS/ELINCS/NLP) | 204-616-2 |
| PubChem | 403 |
| ChEBI | 17602 |
| SMILES | Oc1ccc(N)cc1 |
| InChI | 1S/C6H7NO/c7-5-1-3-6(8)4-2-5/h1-4,8H,7H2 |
| Vlastnosti | |
| Molární hmotnost | 109,13 g/mol |
| Teplota tání | 187,5 °C (460,6 K)[1] |
| Teplota varu | 284 °C (557 K)[1] |
| Disociační konstanta pKa | 5,48 (konjugovaná kyselina, pKa1) 10,46 (konjugovaná kyselina, pKa2)[1] |
| Rozpustnost ve vodě | 0,65 g/100 ml (24 °C)[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethylmethylketonu, acetonu, acetonitrilu, ethylacetátu, dimethylsulfoxidu a ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v toluenu a diethyletheru g/100 ml[1] |
| Tlak páry | 5,3 mPa[1] |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −190,6 kJ/mol[1] |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H302 H332 H341 H400 H410[1] |
| P-věty | P201 P202 P261 P264 P270 P271 P273 P281 P301+312 P304+312 P304+340 P308+313 P312 P330 P391 P405 P501[1] |
| Teplota vzplanutí | 195 °C (468 K)[1] |
Některá data mohou pocházet z datové položky. | |
4-Aminofenol (též nazývaný para-aminofenol nebo p-aminofenol) je organická sloučenina se vzorcem H2NC6H4OH. Obvykle je dostupný jako bílý prášek,[2] používá se jako vývojka v černobílé fotografii.
Vzhledem ke svým mírně hydrofobním vlastnostem je rozpustný v alkoholech a může být rekrystalizován z horké vody. Za přítomnosti zásady se snadno oxiduje. Jeho methylované deriváty N a N,N-dimethylaminofenol jsou také komerčně významné látky.
Tato sloučenina je jedním ze tří izomerních aminofenolů, společně s 2-aminofenolem a 3-aminofenolem.
Výroba a příprava
Z fenolu
4-aminofenol se vyrábí z fenolu nitrací a následnou redukcí vzniklého 4-nitrofenolu železem. Další možností je částečná hydrogenace nitrobenzenu na fenylhydroxylamin, který se přesmykuje převážně na 4-aminofenol:[3]
- C6H5NO2 + 2 H2 → C6H5NHOH + H2O
- C6H5NHOH → HOC6H4NH2
Z nitrobenzenu
4-aminofenol lze připravit z nitrobenzenu elektrolytickou přeměnou na fenylhydroxylamin, který se samovolně přesmykuje na 4-aminofenol.[4]
Použití
4-Aminofenol se používá v organické chemii na přípravu složitějších sloučenin. Jde o poslední meziprodukt při průmyslové výrobě paracetamolu, který vzniká jeho reakcí s acetanhydridem:[5][6][7]
Reference
V tomto článku byl použit překlad textu z článku 4-Aminophenol na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m 4-Aminophenol. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ CRC Handbook of Chemistry and Physics 65th Ed.
- ↑ Mitchell, S.C. & Waring, R.H. "Aminophenols." In Ullmann’s Encyclopedia of Industrial Chemistry; 2002 Wiley-VCH, DOI:10.1002/14356007.a02_099
- ↑ K. Polat; M. L. Aksu; A. T. Pekel. Electroreduction of nitrobenzene to p-aminophenol using voltammetric and semipilot scale preparative electrolysis techniques. Journal of Applied Electrochemistry. Kluwer Academic Publishers, 2002, s. 217–223. DOI 10.1023/A:1014725116051.
- ↑ Frank Ellis. Paracetamol: a curriculum resource. Cambridge: Royal Society of Chemistry, 2002. Dostupné online. ISBN 0-85404-375-6.
- ↑ Anthony S. Travis. The chemistry of Anilines Part 1. Příprava vydání Zvi Rappoport. [s.l.]: Wiley, 2007. ISBN 978-0-470-87171-3. Kapitola Manufacture and uses of the anilines: A vast array of processes and products, s. 764.
- ↑ FRIDERICHS, Elmar; CHRISTOPH, Thomas; BUSCHMANN, Helmut. Analgesics and Antipyretics. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a02_269.pub2. (anglicky) DOI: 10.1002/14356007.a02_269.pub2.
Externí odkazy
 Obrázky, zvuky či videa k tématu 4-aminofenol na Wikimedia Commons
Obrázky, zvuky či videa k tématu 4-aminofenol na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Space-filling model of 4-aminophenol. Created using Accelrys DS Visualizer Pro 1.6 and GIMP.
Structure of p-Aminophenol
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances