Peroxodisíran sodný
| Peroxodisíran sodný | |
|---|---|
 strukturní vzorec | |
| Obecné | |
| Sumární vzorec | Na2S2O8 |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 7775-27-1 |
| EC-no (EINECS/ELINCS/NLP) | 231-892-1 |
| PubChem | 62655 |
| SMILES | [Na+].[Na+].O=S(=O)([O-])OOS([O-])(=O)=O |
| InChI | S/2Na.H2O8S2/c;;1-9(2,3)7-8-10(4,5)6/h;;(H,1,2,3)(H,4,5,6)/q2*+1;/p-2 |
| Vlastnosti | |
| Molární hmotnost | 238,10 g/mol |
| Teplota tání | °C ( K) |
| Teplota varu | °C ( K) |
| Hustota | 1,1 g/cm3[1] |
| Rozpustnost ve vodě | 55,6 g/100 ml (20 °C)[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H272 H302 H315 H317 H319 H334 H335[1] |
| P-věty | P210 P220 P233 P260 P261 P264+265 P270 P271 P272 P280 P284 P301+317 P302+352 P304+340 P305+351+338 P319 P321 P330 P332+317 P333+317 P337+317 P342+316 P362+364 P370+378 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Peroxodisíran sodný je anorganická sloučenina se vzorcem Na2S2O8, sodná sůl kyseliny peroxodisírové, H2S2O8, s oxidujícími vlastnostmi. Vytváří bílé krystaly rozpustné ve vodě.
Výroba
Peroxodisíran sodný se vyrábí elektrolytickou oxidací hydrogensíranu sodného:
- 2 NaHSO4 → Na2S2O8 + H2
Oxidace probíhá na platinové anodě.[2]
Standardní redoxní potenciál přeměn peroxodisíranu na hydrogensíran je 2,1 V, vyšší než u odpovídající reakce peroxidu vodíku (1,8 V) ale nižší než u ozonu (2,2 V).[3] Síranový radikál má standardní elektrodový potenciál 2,7 V.
Používání platinových elektrod na výrobu solí má několik nevýhod; výroba má v důsledku tvorby kyslíku nízkou účinnost a produkt často obsahuje nečistoty, vzniklé hlavně v důsledku silně oxidujících vlastností síranového radikálu. Místo platiny lze jako materiál elektrod použít diamant obohacený o bor.[4]
Struktura
Peroxodisíran sodný a draselný mají v pevném skupenství podobné struktury; u sodné soli je délka vazeb O-O 147,6 pm. Síranové skupiny jsou tetraedrické, s třemi krátkými vazbami S-O o délkách 144 pm a jednou dlouhou (164 pm).[5]
Použití
Peroxodisírany se používají jako radikálové iniciátory emulzních polymerizací sloužících k výrobě styrenových polymerů, jako je akrylonitrilbutadienstyren.[6]
Organická chemie
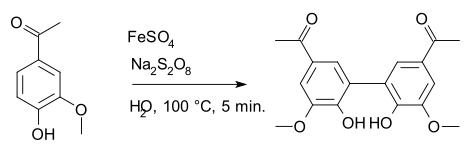
Peroxodisíran sodný se používá jako oxidační činidlo při Elbsově peroxodisíranové oxidaci a Boylandově–Simsově oxidaci. Zapojuje se také do radikálových reakcí, jako je přeměna apocyninu na diapocynin, kde jako radikálový iniciátor slouží síran železnatý.[7]
Ostatní
Tato látka se používá také jako bělidlo, jak samostatně (v kosmetice), tak i jako složka detergentů. Využití má také například při úpravě vody,[4][8] výrobě barev a úpravě škrobu.
Bezpečnost
Peroxodisíran sodný je oxidačním činidlem a s organickými materiály, jako je papír, vytváří hořlavé směsi.
Reference
V tomto článku byl použit překlad textu z článku Sodium persulfate na anglické Wikipedii.
- ↑ a b c d e f https://pubchem.ncbi.nlm.nih.gov/compound/62655
- ↑ Pietzsch, A.; Adolph, G. Journal of Chemical Technology & Biotechnology 1911, 30, 85
- ↑ Block, Philip A., Richard A. Brown, and David Robinson. "Novel activation technologies for sodium persulfate in-situ chemical oxidation" Proceedings of the Fourth International Conference on the remediation of chlorinated and recalcitrant compounds. 2004
- ↑ a b Saiful Arifin Shafiee; Jolyon Aarons; Hamzah Hairul Hisham. Electroreduction of Peroxodisulfate: A Review of a Complicated Reaction. Journal of the Electrochemical Society. 2018, s. H785–H798. Dostupné online. DOI 10.1149/2.1161811jes.
- ↑ ALLAN, David R. Sodium peroxodisulfate. Acta Crystallographica Section E. 2006, s. i44–i46. DOI 10.1107/S1600536806004302. (anglicky)
- ↑ JAKOB, Harald; LEININGER, Stefan; LEHMANN, Thomas. Peroxo Compounds, Inorganic. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a19_177.pub2. (anglicky) DOI: 10.1002/14356007.a19_177.pub2.
- ↑ Ron Luchtefeld, Mina S. Dasari, Kristy M. Richards, Mikaela L. Alt, Clark F. P. Crawford, Amanda Schleiden, Jai Ingram, Abdel Aziz Amadou Hamidou, Angela Williams, Patricia A. Chernovitz, Grace Y. Sun, Rensheng Luo, Robert E. Smith. Synthesis of Diapocynin. Journal of Chemical Education. 2008, s. 411. DOI 10.1021/ed085p411. Bibcode 2008JChEd..85..411D.
- ↑ Stanisław Wacławek; Holger V. Lutze; Klaudiusz Grübel; Vinod V. T. Padil; Miroslav Černík; Dionysios. D. Dionysiou. Chemistry of persulfates in water and wastewater treatment: A review. Chemical Engineering Journal. 2017, s. 44–62. DOI 10.1016/j.cej.2017.07.132.
Externí odkazy
 Obrázky, zvuky či videa k tématu Peroxodisíran sodný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Peroxodisíran sodný na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Autor: Joris Dolderer, Licence: CC BY-SA 2.5
Darstellung zeigt die Strukturformel von Natriumpersulfat