Pinoresinol
| Pinoresinol | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | 4-[(3S,3aR,6S,6aR)-6-(4-hydroxy-3-methoxyfenyl)-1,3,3a,4,6,6a-hexahydrofuro[3,4-c]furan-3-yl]-2-methoxyfenol |
| Sumární vzorec | C20H22O6 |
| Identifikace | |
| Registrační číslo CAS | 487-36-5 |
| PubChem | 73399 |
| SMILES | COC1=C(C=CC(=C1)C2C3COC(C3CO2)C4=CC(=C(C=C4)O)OC)O |
| InChI | 1S/C20H22O6/c1-23-17-7-11(3-5-15(17)21)19-13-9-26-20(14(13)10-25-19)12-4-6-16(22)18(8-12)24-2/h3-8,13-14,19-22H,9-10H2,1-2H3/t13-,14-,19+,20+/m0/s1 |
| Vlastnosti | |
| Molární hmotnost | 358,39 g/mol |
Některá data mohou pocházet z datové položky. | |
Pinoresinol je tetrahydrofuranový lignan[1] nacházející se v sturačích (Styrax sp.), zlatici převislé (Forsythia suspensa) a zlatici korejské (Forsythia koreana).[2][3]
Také byl nalezen v housenkách běláska řepového (Pieris rapae), kde slouží k ochraně před mravenci.[4]
U potravin byl nalezen v sezamových semenech, brukvích[5] a olivovém oleji.[6]
Pinoresinol je toxický pro larvy některých druhů hmyzu, jako jsou Oncopeltus fasciatus a Rhodnius prolixus, vektor Chagasovy choroby.[7]
Pinoresinol se z rostlin dosud nepodařilo získat s větší účinností.[8]
Biosyntéza
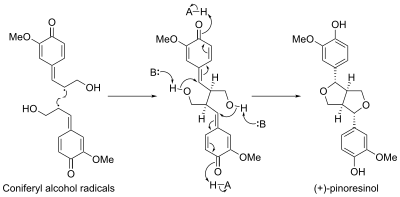
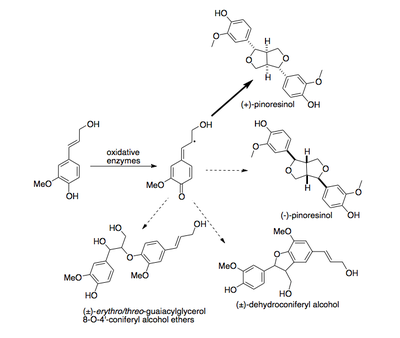
První dirigentový protein, objevený u zlatice prostřední (Forsythia intermedia), řídí přímou stereoselektivní biosynthézu (+)-pinoresinolu z koniferylalkoholu.[9]
Druhý dirigentový protein byl nalezen u huseníčku rolního (Arabidopsis thaliana) a řídí enantioselektivní syntézu (-)-pinoresinolu.[10]
Farmakologické vlastnosti
Pinoresinol inhibuje enzym α-glukosidázu a může tak snižovat hladinu cukru v krvi.[11] Pinoresinol má in vitro chemopreventivní vlastnosti. Způsobuje také navýšení míry apoptózy ve fázi G2/M u buměk chránících proti p53.[12]
Pinoresinol z olivového oleje zlepšuje absorpci vitaminu D ve střevech.[13]
Metabolismus
Pinoresinol je, podobně jako další rostlinné lignany, střevními bakteriemi přeměňován na enterolignany.[14]
Reference
V tomto článku byl použit překlad textu z článku Pinoresinol na anglické Wikipedii.
- ↑ Csilla Páska; Gabbriella Innocenti; Mariagrazia Ferlin; Mónika Kunvári; Miklós László. Pinoresinol from Ipomoea Cairica Cell Cultures. Natural Product Letters. 2002, s. 359–363. Dostupné online. ISSN 1057-5634. DOI 10.1080/1057530290033123.
- ↑ Hyo Won Jung; Ramalingam Mahesh; Jong Gu Lee; Seung Ho Lee; Young Shik Kim; Yong-Ki Park. Pinoresinol from the fruits of Forsythia koreana inhibits inflammatory responses in LPS-activated microglia. Neuroscience Letters. 2010, s. 215–220. Dostupné online. ISSN 0304-3940. DOI 10.1016/j.neulet.2010.06.043.
- ↑ Laurence B. Davin; Diana L. Bedgar; Takeshi Katayama; Norman G. Lewis. On the stereoselective synthesis of (+)-pinoresinol in Forsythia suspensa from its achiral precursor, coniferyl alcohol. Phytochemistry. 1992, s. 3869–3874. DOI 10.1016/S0031-9422(00)97544-7. PMID 11536515.
- ↑ F. C. Schroeder; M. L. Del Campo; J. B. Grant; D. B. Weibel; S. R. Smedley; K. L. Bolton; J. Meinwald. Pinoresinol: A lignol of plant origin serving for defense in a caterpillar. Proceedings of the National Academy of Sciences. 2006, s. 15497–15501. DOI 10.1073/pnas.0605921103. PMID 17030818. Bibcode 2006PNAS..10315497S.
- ↑ Ivon E. J. Milder; Ilja C. W. Arts; Betty van de Putte; Dini P. Venema; Peter C. H. Hollman. Lignan contents of Dutch plant foods: A database including lariciresinol, pinoresinol, secoisolariciresinol and matairesinol. British Journal of Nutrition. 2007, s. 393–402. DOI 10.1079/BJN20051371. PMID 15877880.
- ↑ R. W. Owen; A. Giacosa; W. E. Hull; R. Haubner; B. Spiegelhalder; H. Bartsch. The antioxidant/anticancer potential of phenolic compounds isolated from olive oil. European Journal of Cancer. 2000, s. 1235–1247. DOI 10.1016/S0959-8049(00)00103-9. PMID 10882862.
- ↑ M. M. O. Cabral; A. Kelecom; E. S. Garcia. Effects of the lignan, pinoresinol on the moulting cycle of the bloodsucking bug Rhodnius prolixus and of the milkweed bug Oncopeltus fasciatus. Fitoterapia. 1999, s. 561–567. Dostupné online. ISSN 0367-326X. DOI 10.1016/s0367-326x(99)00089-1.
- ↑ Yongkun Lv; Xiaozhong Cheng; Guocheng Du; Jingwen Zhou; Jian Chen. Engineering of an H2O2 auto-scavenging in vivo cascade for pinoresinol production. Biotechnology and Bioengineering. 2017-05-12, s. 2066–2074. Dostupné online. ISSN 0006-3592. DOI 10.1002/bit.26319.
- ↑ L. B. Davin; H. B. Wang; A. L. Crowell. Stereoselective bimolecular phenoxy radical coupling by an auxiliary (dirigent) protein without an active center. Science. 1997, s. 362–366. DOI 10.1126/science.275.5298.362. PMID 8994027.
- ↑ B. Pickel; M. A. Constantin; J. Pfannsteil; J. Conrad; U. Beifuss; A. Schaffer. An Enantiocomplementary Dirigent Protein for the Enantioselective Laccase-Catalyzed Oxidative Coupling of Phenols. Angewandte Chemie. 2007, s. 273–284. DOI 10.1007/s10086-007-0892-x.
- ↑ A. Wikul; T. Damsud; K. Kataoka; P. Phuwapraisirisan. (+)-Pinoresinol is a putative hypoglycemic agent in defatted sesame (Sesamum indicum) seeds though inhibiting α-glucosidase. Bioorganic & Medicinal Chemistry Letters. 2012, s. 5215–5217. DOI 10.1016/j.bmcl.2012.06.068. PMID 22818971.
- ↑ L. Fini, E. Hotchkiss, V. Fogliano, G. Graziani, M. Romano, E. B. De Vol, H. Qin, M. Selgrad, C. R. Boland, L. Ricciardiello. Chemopreventive properties of pinoresinol-rich olive oil involve a selective activation of the ATM-p53 cascade in colon cancer cell lines. Carcinogenesis. 2008, s. 139–146. DOI 10.1093/carcin/bgm255. PMID 17999988.
- ↑ Aurélie Goncalves; Marielle Margier; Camille Tagliaferri; Patrice Lebecque; Stéphane Georgé; Yohann Wittrant. Pinoresinol of olive oil decreases vitamin D intestinal absorption. Food Chemistry. 2016, s. 234–238. Dostupné online. ISSN 0308-8146. DOI 10.1016/j.foodchem.2016.03.048.
- ↑ I. E. Milder; I. C. Arts; B. Van De Putte; D. P. Venema; P. Venema. Lignan contents of Dutch plant foods: A database including lariciresinol, pinoresinol, secoisolariciresinol and matairesinol. The British Journal of Nutrition. 2005, s. 393–402. DOI 10.1079/BJN20051371. PMID 15877880.
Externí odkazy
 Obrázky, zvuky či videa k tématu Pinoresinol na Wikimedia Commons
Obrázky, zvuky či videa k tématu Pinoresinol na Wikimedia Commons
Média použitá na této stránce
Autor: Hbf878, Licence: CC0
Chemical structure of pinoresinol without definition of the four stereocenters.
Autor: User:Bbarad, Licence: CC BY-SA 3.0
Stereoselective biosynthesis of (+)-pinoresinol from coniferyl alcohol radicals. A denotes an acid, B denotes a base.
Autor: Bbarad, Licence: CC BY-SA 3.0
Dirigent protein increases the selectivity of the coupling of coniferyl alcohol radicals.