Pniktogenovodíky
Pniktogenovodíky jsou kovalentní sloučeniny pniktogenů (prvků 15. skupiny periodické tabulky) s vodíkem.
Trihydridy pniktogenů
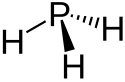
Nejjednodušší příklady mají chemický vzorec XH3, kde X může být libovolný pniktogen. Mají pyramidální molekuly na rozdíl od hydridů trielů, jejichž molekuly jsou rovinného trojúhelníkovitého tvaru. S rostoucím protonovým číslem prvku klesá jejich stabilita a stávají se více toxickými.
Podobně jako halogenovodíky a chalkogenovodíky jsou rozpustné ve vodě. Amoniak je dobře rozpustný a na rozdíl od hydridů ostatních prvků bloku p je jeho roztok zásaditý. Fosfan se také rozpouští ve vodě, arsan a stiban jsou méně rozpustné a rozpustnost bismutanu není známa.
| Sloučenina | Chemický vzorec | Délky a úhly vazeb | Model molekuly |
|---|---|---|---|
azan |  |  | |
fosfin |  |  | |
arsin |  |  | |
stibin |  |  | |
bismutin |  |  |
| Vlastnost | NH3 | PH3 | AsH3 | SbH3 | BiH3 |
|---|---|---|---|---|---|
| Teplota tání (°C) | −77,8 | −133,5 | −116,3 | −88 | ? |
| Teplota varu (°C) | −34,5 | −87,5 | −62,4 | −18,4 | 16,8 (odhad) |
| Hustota kapaliny (g/cm3) | 0,683 (−34 °C) | 0,746 (−90 °C) | 1,640 (−64 °C) | 2,204 (−18 °C) | ? |
| ΔH ° f /kJ mol−1 | −46,1 | −9,6 (?) | +66,4 | +145,1 | +277,8 |
| Délka vazby (X–H)/pm | 101,7 | 141,9 | 151,9 | 170,7 | 177,59 |
| Úhel H–X–H | 107,8° | 93,6° | 91,8° | 91,3° | 90,48° |
Zajímavou vlastností těchto sloučenin je, že v čisté podobě nemají žádný zápach, ovšem získávají jej při kontaktu se vzduchem. Amoniak má zápach podobný moči, při jejímž rozkladu také vzniká. Fosfan má zápach jako ryby nebo česnek a stiban jako zkažená vejce, v čemž se podobá sulfanu a selanu.
Tetrahydridy dipniktogenů
| Sloučenina | Chemický vzorec | Délka vazby | Model molekuly |
|---|---|---|---|
diazan |  |  | |
difosfin | 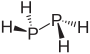 |  | |
diarsin |
Vlastnosti
Všechny nasycené pniktogenovodíky mají vzorec XnHn+2.
Amoniak má díky vodíkovým vazbám vysokou teplotu tání a varu, podobně jako voda. 26 % jich zaniká při tání, dalších 7 % při zahřívání k varu a zbylých 67 % u plynného skupenství. Vodíkové vazby také způsobují vysokou dielektrickou konstantu a nízkou hustotu, viskozitu a elektrickou vodivost. S vodou má společné i to, že jde o velmi dobré a často používané rozpouštědlo. Je známo asi 20 dalších sloučenin dusíku a vodíku, z nichž jsou nejvýznamnější hydrazin (N2H4) a azoimid (N3H). Fyzikální vlastnosti hydrazinu jsou podobné jako u vody: teplota tání 2,0 °C a teplota varu 113,5 °C, hustota pevné látky při -5 °C je 1,146 g/cm3 a kapaliny při 25 °C 1,00 g/cm3. Azany tvoří řadu obsahující amoniak, hydrazin a triazan.
Fosfan, toxický bezbarvý plyn, je nejstabilnější hydrid fosforu a první člen homologické řady polyfosfanů PnHn+2 (n = 1-9), které jsou s rostoucím n stále méně stabilní. Jsou známy rovněž jiné série cyklických a kondenzovaných polyfosfanů od PnHn do PnHn-18. Fosfan je silné redukční činidlo nerozpustné ve vodě, rozpustné v sirouhlíku a kyselině trichloroctové.
Arsan, stiban a bismutan jsou vysoce toxické, tepelně nestabilní a bezbarvé plyny. V fosfanu, arsanu, stibanu a bismutanu se nevyskytují vodíkové vazby a tyto látky nedisociují jako amoniak na MH +
4 a MH -
2 (M = P, As, Sb, Bi). S rostoucím protonovým číslem pniktogenu klesá standardní slučovací entalpie, což je v souladu s klesající stabilitou. Arsan se rozkládá na arsen a vodík při teplotě 250-300 °C, stiban na antimon a vodík za pokojové teploty a bismutan už při -45 °C. Arsan a stiban se snadno oxidují na oxid arsenitý/antimonitý a vodu; podobné reakce probíhají u sulfanu a selanu. Reakce s kovy vedou ke vzniku arsenidů a selenidů.
Imidogen, radikál složený z jednoho atomu dusíku a jednoho vodíku (NH), stejně jako diimid (N2H2) lze také řadit mezi pniktogenovodíky.
Reference
V tomto článku byl použit překlad textu z článku Pnictogen hydride na anglické Wikipedii.
Externí odkazy
 Obrázky, zvuky či videa k tématu Pniktogenovodíky na Wikimedia Commons
Obrázky, zvuky či videa k tématu Pniktogenovodíky na Wikimedia Commons
Média použitá na této stránce
Structure of Diphosphane
Structural formula of the bismuthine molecule, BiH3. The molecule belongs to the C3v point group.
Structural information (determined by microwave and infrared spectroscopy) from:
W. Jerzembeck, H. Bürger, L. Constantin, L. Margulès, J. Demaison, J. Breidung, W. Thiel (2002). "Bismuthine BiH3: Fact or Fiction? High-Resolution Infrared, Millimeter-Wave, and Ab Initio Studies". Angew. Chem. Int. Ed. 41 (14): 2550–2552. Archived from the original on 2013-01-05. Retrieved on 2009-02-18.
doi:10.1002/1521-3773(20020715)41:14<2550::AID-ANIE2550>3.0.CO;2-BBismuthine-3D-vdW
Space-filling model of the ammonia molecule, NH3
Structure and dimensions of the ammonia molecule, NH3.
Dimensions from:Greenwood, N. N.; Earnshaw, A. (1997) Chemistry of the Elements (2. ed.), Oxford:Butterworth-Heinemann, pp. p. 423 ISBN: 0-7506-3365-4.
Arsine-3D-vdW
Phosphine-3D-vdW
Autor: Jynto (talk), Licence: CC0
Space-filling model of the diphosphane molecule, one of several binary phosphorus hydrides.
Colour code:
- Hydrogen, H: white
- Phosphorus, P: orange
Space-filling model of the hydrazine molecule, N2H4. Gas phase electron diffraction data from Kunio Kohata, Tsutomu Fukuyama, and Kozo Kuchitsu (1983). "Molecular structure of hydrazine as studied by gas electron diffraction". The Journal of Physical Chemistry 86: 602-606. DOI:10.1021/j100394a005.
Structure of Monophosphane (Phosphine)
Structure of Hydrazine
Description: Chemical structure of stibine
- Author, date of creation: selfmade by Ben, 3 April 2006
- Source: self-made
- Copyright: Public Domain (PD)
- Comments: b/w hi-res PNG; ChemDraw