Poliovirus
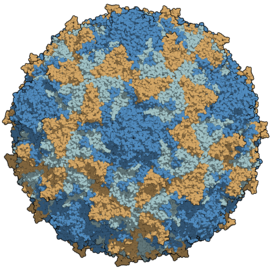 Struktura virové kapsidy. Barevně odlišené postranní řetězce proteinů. | |
| Baltimorova klasifikace virů | |
| Skupina | IV. (ssRNA viry s kladnou polaritou) |
| Vědecká klasifikace | |
| Realm | Riboviria |
| Říše | Orthornavirae |
| Kmen | Pisuviricota |
| Třída | Pisoniviricetes |
| Řád | Picornavirales |
| Čeleď | Picornaviridae |
| Rod | Enterovirus |
| Druh | Enterovirus C |
| Poddruh | Poliovirus |
| Některá data mohou pocházet z datové položky. | |
Poliovirus (virus poliomyelitidy, PV) je neobalený RNA virus způsobující infekční onemocnění dětskou obrnu. Řadí se mezi lidské enteroviry C v rámci rodiny picornavirů.[1] Jsou známé 3 serotypy poliovirů: PV1, PV2 a PV3. Hostitelem mohou být primáti nebo člověk. Vlivem očkování došlo téměř k jeho vymýcení.
Historie
Za nejstarší zobrazení člověk s následky poliomyelitidy se považuje staroegyptský stéla, na které má pokřivenou a hypotrofickou nohu po prodělaném hořečnatém onemocnění. Ve spisech Hippokrata je taktéž možné najít záznamy o nemoci vyskytující se v letních měsících a způsobující obrny končetin.[2]
V roce 1838 německý lékař Jakob von Heine popsal poprvé klinické projevy dětské obrny. O více než 50 let později švédský dětský lékař Karl Oskar Medin zjistil, že onemocnění se může přenášet mezi lidmi a o dalších 20 let později Karl Landsteiner popsal virus dětské obrny. První inaktivovaná vakcína byla připravena v roce 1954 Jonasem E. Salkem.[3]
Stavba
Virion je tvořen, stejně jako další picornaviry např. rhinoviry, neobalenou kapsidou, která má ikosahedrální tvar s vnějším průměrem asi 300 Å (30 nm). Každá kapsida obsahuje 60 kopií tří povrchových virových proteinů: VP1, VP2 a VP3, a také 60 kopií interně umístěného VP4. Tři povrchové proteiny zaujímají strukturu antiparalelního β-barelu. Tento motiv je poměrně běžný pro kapsidy dalších virů.[4] Povrch kapsidy má vlnitou topografii: prominentní vrchol ve tvaru hvězdy je obklopený hlubokou prohlubní a dalšími výčnělky.[5] Tato struktura vytváří takové žlábky pro navázání na poliovirový receptor, jehož rozpoznání je klíčové pro vstup virové genetické informace do hostitelské buňky.[1]

Genetická informace je nesena jednovláknovou RNA s pozitivní polaritou ((+)ssRNA), která se skládá přibližně z 7 500 bází. Genomová RNA je na 3´konci adenylována, čímž je zajištěna její stabilita, a na 5´konci kovalentně navázána na virový protein spojený s genomem (VPg-viral protein genome-linked) protein. Pro vytvoření nových částic virus využívá hostitelský ribosomální aparát, tudíž virová translace může probíhat bez potřeby virových proteinů. Studie sekvencí RNA prokázaly, že všechny poliovirové polypeptidy se tvoří z jedné prekurzorové molekuly nekapsidálního virálního proteinu. Na 5´konci se dále nachází netranslatovaná oblast obsahující sekvenci, rozpoznávající ribosomem, vnitřní místo pro vstup ribosomu (IRES). Mutace v rámci sekvence IRES u atenuovaných kmenů mohou způsobit problémy při translaci či ji kompletně znemožnit.[1][6][7]
Klasifikace
Virus lze s využitím Baltimorovy klasifikace zařadit do skupiny 4, tedy do skupiny virů s jednovláknovým RNA genomem s kladnou polaritou. Genomová RNA může rovnou sloužit jako messengerová RNA, je tedy sama o sobě infekční a může se množit s využitím hostitelského aparátu. Do této skupiny dále patří např. Picornaviridae (polioviry, rhinoviry), virus hepatitidy A, Flavivirus, Togavirus, Koronavirus.[8]
Životní cyklus
Vstup do buňky

Virus vstupuje do organismu orální cestou, tedy hostitelské jsou buňky gastrointestinálního traktu. Je schopen napadnout buňky tenkého střeva, což mu umožňuje jeho zvýšená odolnost vůči nízkému pH nacházející se v žaludku. [1]
Infekce poliovirem je zahájena rozpoznáním povrchových buněčných receptorů Pvr (CD155). Pro infekci cílové buňky dochází k navázání na hostitelský membránový protein, který se podílí především na tvorbě adherentních spojů mezi sousedícími epiteliálními buňkami. Tyto proteiny také slouží jako receptory pro herpesviry. U těchto virů receptor ještě iniciuje konformační změny v kapsidě, které pomáhají rozbalit proteiny kapsidy a umožnit uvolnit genomovou informaci. Dochází tedy ke konformační změně kapsidy, kdy je jeden kapsidový protein viru vsunut do buněčné membrány, utvoří pór skrz nějž je následně vpraven virový genom do cytoplasmy. [1][4][5]
Translace
Po vstupu genomu do buňky dochází k translaci virových proteinů hostitelským ribozomálním aparátem, což je umožněno díky přítomnosti IRES sekvence, která slouží jako náhrada pro strukturu eukaryotické 5´čepičky (CAP) , kterou běžně hostitel rozpoznává. Následně dochází k translaci jednoho celistvého polyproteinu přibližné délky 3000 aminokyselin. Polyprotein je následně štěpen pomocí proteáz na jednotlivé funkční proteiny.[1][9]
V pozdější fázi infekce buňky dochází virem k omezení exprese hostitelských genů a zabránění buněčné antivirové obrany. To může být docíleno štěpením eukaryotických iniciačních faktorů (eIF), které jsou běžně esenciální pro zahájení translace mRNA, a nebo poškozením funkčnosti jaderných pórů. Virus také obsahuje enzymy schopně inaktivovat proteiny vázající CAP strukturu, což má za následek sníženou kompetici mezi virovou a hostitelskou RNA a dojde k preferování translace RNA obsahující virovou IRES sekvenci.[1][7]
Replikace a transkripce
Virová RNA má na 5´konci vlákna kovalentně navázaný protein VPg, který slouží jako primer pro zahájení transkripce. Dále obsahuje replikační element, který vytváří smyčku sloužící pro vazbu příslušných proteinů potřebných pro replikaci.[1]
Při replikaci dochází k vytvoření dvouvláknové RNA, kterou buňka registruje jako důkaz o virové infekci. Aby se zabránilo buněčné imunitní odpovědi, probíhá replikace i transkripce na buněčných membránách organel (endoplasmatického retikula). Virus využívá hostitelského vezikulárního transportu k pučení váčků, ve kterých je zajištěno ideální prostředí pro replikaci RNA. U vzniklého dsRNA intermediátu následně negativní vlákno slouží jako templát pro tvorbu nové genomické ssRNA. Tvorba genomických RNA může probíhat několikanásobně na jednom vlákně (-)ssRNA.[1]
Enkapsidace a opuštění buňky
Po rozštěpení polyproteinu na jednotlivé segmenty se vytvoří struktura kapsidy. Balení RNA do vznikajících kapsid je přímo spojeno s RNA replikací, čímž je zajištěno selekce pouze (+)ssRNA. Ven se virová částice dostává nejčastěji lytickou cestou pomocí pórů, může ale nastat i exocytóza virionů pomocí buněčných veziklů. Z napadených GIT buněk se tak virus může dostat do krevního řečiště, následně infikovat buňky CNS a způsobit paralýzu, nebo se zpět uvolní do stolice, opustí hostitele a dochází k jemu dalšímu šíření.[1]

Onemocnění
Je to vysoce nakažlivé onemocnění přenášející se kapénkovou infekcí. Projevuje se horečnou, zánětem spojivek a drobnou vyrážkou, může docházet k zápalům plic nebo zánětům středního ucha. Ve většině případů probíhá subklinicky bez zjevných známek infekce, ale ve vzácných případech může dojít až k postižení centrálního nervového systému.[3]
Vzácná neurologická komplikace virové infekce se nazývá lidská paralytická poliomyelitida a projevuje se u méně než 1 % infikovaných jedinců. Je charakterizována svalovou slabostí nebo paralýzou v důsledku následnou destrukcí inervačních spinálních motorických nervů. Postižení horní krční a prodloužené míchy má pak za následek obrnu dýchacích svalů.[2] Patologie onemocnění lidské poliomyelitidy byla experimentálně pozorována také u infikovaných šimpanzů a dalších opic.[10]
Léčba dětské obrny je reálně symptomatická. Při obrně postihující dýchací svaly poskytl pomoc ventilátor zvaný železné plíce. Využívajíc negativní tlak působící na hrudní stěnu významně přispěl ke zlepšení prognózy pacientů.[11]
Vakcíny proti dětské obrně
Kvůli narůstající nemocnosti a obavám z epidemie se na jaře 1957 v Československu uskutečnilo masové očkování dětí třemi dávkami inaktivované vakcíny, kdy došlo k proočkování až 94 % dětí mladších patnácti let. Od 2. poloviny roku 1960 se na území Československa nevyskytl žádný případ nezavlečené paralytické poliomyelitidy. Tím jsme se stali první zemí na světě, kde byla nemoc dětské obrny vymýcena.[2] Nyní se v České republice se proti dětské obrně očkuje v rámci kombinované hexavakcíny a následné přeočkování monovakcínou v celkem pěti dávkách. Očkování se provádí inaktivovanou očkovací látkou.[3][12]
Antivirotika
Potenciál antivirotik je důležitý hlavně v případech, že u lidí trpících imunodeficiencí může dojít k propuknutí infekce a znepokojujícím se jeví i fakt, že se virové partikuly mohou uvolňovat do okolí i několik let po primární infekci.[13] Ve Spojených státech amerických je vakcinace proti dětské obrně spojena se 4 až 5 případy paralytické obrny ročně. V rozvojových zemích zůstává obrna i přes snahy o vymýcení vážnou hrozbou. U dlouhé chronické nákazy se zvyšuje také riziko mutací, na které by nemuselo fungovat očkování. Ukázalo se, že žádná léčba zatím není účinná při léčbě infekcí centrálního nervového systému poliovirem.[14] V roce 2006 došlo ke zformování Poliovirové Antivirální Iniciativy (PAI), která má za úkol vytvořit alespoň dva druhy antivirotik s odlišným mechanismem účinku.
Pleconaril je nové antivirové činidlo, které vykazuje aktivitu proti širokému spektru enterovirů. Hlavní mechanismus účinku tohoto antivirotika spočívá v inhibici proteinů související s navázáním viru na hostitelskou buňku.[14]
Dalším slibným antivirotikem se jeví pocapavir, který byl objeven v roce 1996. Pocapavir je studovaný lék, který působí jako inhibitor zabraňující virionu vstoupit do buňky. Vykazuje taktéž aktivitu proti enterovirům, které nejsou spojeny s obrnou, a mohou být užitečné při léčbě závažných enterovirových infekcí. Ve studiích z roku 2017 se jeví být velmi účinný vůči poliovirům, při zvládání infekce během eradikace.[15][16]
Odkazy
Reference
- ↑ a b c d e f g h i j ŠIPKA, Ondřej. Polioviry a poliovirové vakcíny. Praha, 2019 [cit. 2021-05-21]. bakalářská. Univerzita Karlova, Přírodovědecká fakulta, Katedra genetiky a mikrobiologie. Vedoucí práce Alena Drda Morávková. Dostupné online.
- ↑ a b c Aktualita. www.infekce.cz [online]. [cit. 2021-05-16]. Dostupné v archivu pořízeném z originálu dne 2021-05-16.
- ↑ a b c NĚMCOVÁ, Monika. Očkovací kalendář - historie, současnost a budoucnost. dspace.cuni.cz. 2010-06-18. Dostupné online [cit. 2021-05-16].
- ↑ a b HE, Yongning; BOWMAN, Valorie D.; MUELLER, Steffen. Interaction of the poliovirus receptor with poliovirus. Proceedings of the National Academy of Sciences. 2000-01-04, roč. 97, čís. 1, s. 79–84. PMID: 10618374. Dostupné online [cit. 2021-05-17]. ISSN 0027-8424. doi:10.1073/pnas.97.1.79. PMID 10618374. (anglicky)
- ↑ a b BELNAP, David M.; MCDERMOTT, Brian M.; FILMAN, David J. Three-dimensional structure of poliovirus receptor bound to poliovirus. Proceedings of the National Academy of Sciences. 2000-01-04, roč. 97, čís. 1, s. 73–78. PMID: 10618373. Dostupné online [cit. 2021-05-17]. ISSN 0027-8424. doi:10.1073/pnas.97.1.73. PMID 10618373. (anglicky)
- ↑ WIMMER, Eckard; HELLEN, Christopher U. T.; CAO, Xuemei. Genetics of Poliovirus. Annual Review of Genetics. 1993-12, roč. 27, čís. 1, s. 353–436. Dostupné v archivu pořízeném dne 2021-05-20. ISSN 0066-4197. doi:10.1146/annurev.ge.27.120193.002033. (anglicky)
- ↑ a b NOMOTO, Akio; OMATA, Toshiko; TOYODA, Haruka. Complete Nucleotide Sequence of the Attenuated Poliovirus Sabin 1 Strain Genome. Proceedings of the National Academy of Sciences of the United States of America. 1982, roč. 79, čís. 19, s. 5793–5797. Dostupné online [cit. 2021-05-20]. ISSN 0027-8424.
- ↑ TANKESHWAR, Acharya. Learn Microbiology Online [online]. 2016-06-30 [cit. 2021-05-17]. Dostupné online. (anglicky)
- ↑ PATHAK, Harsh B.; OH, Hyung Suk; GOODFELLOW, Ian G. Picornavirus Genome Replication. Journal of Biological Chemistry. 2008-11, roč. 283, čís. 45, s. 30677–30688. Dostupné online [cit. 2021-05-20]. doi:10.1074/jbc.M806101200. (anglicky)
- ↑ The neuropathology observed in wild-type mice inoculated with human poliovirus mirrors human paralytic poliomyelitis. Microbial Pathogenesis. 2002-09-01, roč. 33, čís. 3, s. 97–107. Dostupné online [cit. 2021-05-17]. ISSN 0882-4010. doi:10.1006/mpat.2002.0512. (anglicky)
- ↑ The Iron Lung. Science Museum [online]. [cit. 2021-05-16]. Dostupné online. (anglicky)
- ↑ OČKOVÁNÍ proti dětské přenosné obrně. www.vakciny.net [online]. [cit. 2021-05-16]. Dostupné online.
- ↑ MACLENNAN, Calman; DUNN, Glynis; HUISSOON, Aarnoud P. Failure to clear persistent vaccine-derived neurovirulent poliovirus infection in an immunodeficient man. The Lancet. 2004-05, roč. 363, čís. 9420, s. 1509–1513. Dostupné online [cit. 2021-05-20]. doi:10.1016/S0140-6736(04)16150-3. (anglicky)
- ↑ a b ROMERO, Jose R.; GROSS, Thomas; ABROMOWITCH, Minnie. Pleconaril Treatment of Vaccine-Acquired Poliovirus. Pediatric Research. 1999-04, roč. 45, čís. 7, s. 173–173. Dostupné online [cit. 2021-05-20]. ISSN 1530-0447. doi:10.1203/00006450-199904020-01026. (anglicky)
- ↑ COLLETT, Marc S.; HINCKS, Jeffrey R.; BENSCHOP, Kimberley. Antiviral Activity of Pocapavir in a Randomized, Blinded, Placebo-Controlled Human Oral Poliovirus Vaccine Challenge Model. The Journal of Infectious Diseases. 2017-02-01, roč. 215, čís. 3, s. 335–343. Dostupné online [cit. 2021-05-20]. ISSN 0022-1899. doi:10.1093/infdis/jiw542.
- ↑ BUONTEMPO, P. J.; COX, S.; WRIGHT-MINOGUE, J. SCH 48973: a potent, broad-spectrum, antienterovirus compound.. Antimicrobial Agents and Chemotherapy. 1997-06-01, roč. 41, čís. 6, s. 1220–1225. PMID: 9174174. Dostupné v archivu pořízeném dne 2021-05-20. ISSN 0066-4804. doi:10.1128/AAC.41.6.1220. PMID 9174174. (anglicky)
Literatura
- PATHAK, Harsh B. Picornavirus Genome Replication. Journal of Biological Chemistry. 2008, roč. 283, čís. 45, s. 30 677 – 30 688. Dostupné online.
- WIMMER, Eckard. Genetics of Poliovirus. Annual Review of Genetics. 1993, roč. 27, čís. 1, s. 353–436. Dostupné v archivu pořízeném dne 2021-05-20.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Poliovirus na Wikimedia Commons
Obrázky, zvuky či videa k tématu Poliovirus na Wikimedia Commons

Přečtěte si prosím pokyny pro využití článků o zdravotnictví.
Média použitá na této stránce
Autor:
- Information-silk.png: Mark James
- derivative work: KSiOM(Talk)
A tiny blue 'i' information icon converted from the Silk icon set at famfamfam.com
Star of life, blue version. Represents the Rod of Asclepius, with a snake around it, on a 6-branch star shaped as the cross of 3 thick 3:1 rectangles.
Design:
The logo is basically unicolor, most often a slate or medium blue, but this design uses a slightly lighter shade of blue for the outer outline of the cross, and the outlines of the rod and of the snake. The background is transparent (but the star includes a small inner plain white outline). This makes this image usable and visible on any background, including blue. The light shade of color for the outlines makes the form more visible at smaller resolutions, so that the image can easily be used as an icon.
This SVG file was manually created to specify alignments, to use only integers at the core 192x192 size, to get smooth curves on connection points (without any angle), to make a perfect logo centered in a exact square, to use a more precise geometry for the star and to use slate blue color with slightly lighter outlines on the cross, the rod and snake.
Finally, the SVG file is clean and contains no unnecessary XML elements or attributes, CSS styles or transforms that are usually added silently by common SVG editors (like Sodipodi or Inkscape) and that just pollute the final document, so it just needs the core SVG elements for the rendering. This is why its file size is so small.Muž po mozkové obrně
Autor: Nidia H De Jesus (Crop of original image and caption), Licence: CC BY 2.0
Genomic structure of poliovirus type 1 (Mahoney) [PV1(M)] The PV genome consists of a single-stranded, positive-sense polarity RNA molecule, which encodes a single polyprotein. The 5' non-translated region (NTR) harbors two functional domains, the cloverleaf and the internal ribosome entry site (IRES), and is covalently linked to the viral protein VPg. The 3'NTR is poly-adenylated.
Autor: Nidia H De Jesus (image and caption), Licence: CC BY 2.0
The cellular life cycle of poliovirus. It is initiated by binding of a poliovirion to the cell surface macromolecule CD155, which functions as the receptor (1). Uncoating of the viral RNA is mediated by receptor-dependent destabilization of the virus capsid (2). Cleavage of the viral protein VPg is performed by a cellular phosphodiesterase, and translation of the viral RNA occurs by a cap-independent (IRES-mediated) mechanism (3). Proteolytic processing of the viral polyprotein yields mature structural and non-structural proteins (4). The positive-sense RNA serves as template for complementary negative-strand synthesis, thereby producing a double-stranded RNA (replicative form, RF) (5). Initiation of many positive strands from a single negative strand produces the partially single-stranded replicative intermediate (RI) (6). The newly synthesized positive-sense RNA molecules can serve as templates for translation (7) or associate with capsid precursors to undergo encapsidation and induce the maturation cleavage of VP0 (8), which ultimately generates progeny virions. Lysis of the infected cell results in release of infectious progeny virions (9).
Autor: Manuel Almagro Rivas, Licence: CC BY-SA 4.0
Type 3 poliovirus capsid, colored per chains.
Source: Structural factors that control conformational transitions and serotype specificity in type 3 poliovirus. Filman, D.J., Syed, R., Chow, M., Macadam, A.J., Minor, P.D., Hogle, J.M. (1989) EMBO J. 8: 1567-1579.
Available at: http://www.rcsb.org/pdb/explore/explore.do?structureId=2PLV [Checked on 26 Apr. 2016]
Image created using QuteMol and GIMP.




