Polyfosforečné kyseliny

Kyselina fosforečná je obecně kyselina obsahující pětimocný atom fosforu, na který jsou navázány čtyři atomy kyslíku, jeden dvojnou a tři jednoduchou vazbou, přičemž vytvářejí čtyřstěnnou strukturu s kyslíkovými atomy ve vrcholech. Může dojít k propojení dvou nebo více takovýchto čtyřstěnů pomocí atomu kyslíku, navázaného dvojicí jednoduchých vazeb ke dvěma sousedním čtyřstěnům, čímž mohou vznikat nerozvětvené, rozvětvené a cyklické řetězce i složitější struktury. Na atomy kyslíku, které nespojují tyto jednotky, jsou připojeny kyselé atomy vodíku.
Tímto propojením vznikají polyfosforečné kyseliny s obecným vzorcem Hn+2-2xPnO3n+1-x (n) je počet atomů fosforu a x je počet jednoduchých cyklů, od 0 do (n+2)/2.
Tyto kyseliny, společně se svými solemi a estery, patří k nejvýznamnějším sloučeninám fosforu, díky svému značnému významu v biochemii, mineralogii, agrochemii, farmaceutické chemii, chemickém průmyslu a výzkumu.
Přehled
Kyselina (trihydrogen)fosforečná
Nejjednodušší a nejčastěji využívanou kyselinou fosforu je kyselina trihydrogenfosforečná, H3PO4.
Oligofosforečné a polyfosforečné kyseliny

Molekuly kyseliny trihydrogenfosforečné mohou kondenzovat za vzniku větších molekul a odštěpení molekul vody. Kondenzací menšího počtu molekul vznikají oligofosforečné a z většího počtu polyfosforečné kyseliny.
Jako příklady lze uvést kyselinu difosforečnou, trifosforečnou a tetrafosforečnou, které lze připravit následujícími reakcemi:
- 2 H3PO4 → H4P2O7 + H2O
- H4P2O7 + H3PO4 → H5P3O10 + H2O
- H5P3O10 + H3PO4 → H6P4O13 + H2O
- H4P2O7 + H3PO4 → H5P3O10 + H2O
V hlavních řetězcích polyfosforečných kyselin se střídají atomy fosforu a kyslíku. Přidáním každého dalšího orthofosforečnanového zbytku se do molekula rozšíří o jeden atom vodíku, jeden atom fosforu a tři atomy kyslíku. Obecný sumární vzorec (acyklické) polyfosforečné kyseliny lze zapsat jako Hn+2PnO3n+1 nebo HO(–P(O)(OH)–O–)nH.
Polyfosforečné kyseliny se používají v organické syntéze při cyklizačních a acylačních reakcích.[1][2]
Cyklické polyfosforečné kyseliny
Kondenzací dvou hydroxylových skupin v jedné molekule vznikají cyklické polyfosforečné kyseliny, jako je například kyselina trimetafosforečná:
- H5P3O10 → H3P3O9 + H2O
Kyselina difosforečná
H4P2O7Kyselina trifosforečná
H5P3O10Kyselina tetrafosforečná
H6P4O13Kyselina trimetafosforečná
H3P3O9Oxid fosforečný
P4O10
Mezním případem této vnitřní kondenzace je vznik produktu, u něhož jsou všechny kyslíkové atomy součástí cyklu a nejsou dostupné volné atomy vodíku, což nastává u anhydridů (PnO5n/2), jako je například oxid fosforečný (P4O10).
Soli
Odštěpením vodíkových kationtů (H+) z molekuly fosforečných kyselin vznikají fosforečnanové anionty, při odštěpení jen některých vznikají anionty hydrogenfosforečnanové.
Soli kyseliny trihydrogenfosforečné
Od kyseliny trihydrogenfosforečné jsou odvozeny tyto anionty: dihydrogenfosforečnanový (H2PO -
4 ), hydrogenfosforečnanový (HPO 2-
4 ) a fosforečnanový (PO 3-
4 ).
Lineární oligofosforečnany a polyfosforečnany
Disociací kyseliny difosforečné (H4P2O7) mohou vzniknout čtyři různé anionty H4-kP2O7k−, kde k může mít hodnotu 1 až 4. Odštěpením čtyř vodíkových kationtů se tvoří difosforečnanový anion (P2O 4-
7 ). Kyselina trifosforečná může vytvořit celkem 5 aniontů H5-kP3O10k−, u kterých může k být rovno 1 až 5, a kyselina tetrafosforečná celkem 6.
Podobně i rozvětvené polyfosforečné kyseliny mohou vytvářet různé anionty. Nejjednoduššími případy jsou trifosfonofosforečnanový anion [OP(OPO3)3]9− a jeho částečně disociované obdoby. Obecný vzorec necyklického polyfosforečnanového aniontu je [Hn+2−kPnO3n+1]k−, kde k může být 1 až n+2. Míra disociace závisí na pH roztoku.
Cyklické polyfosforečnany

Jednotlivé zbytky kyseliny fosforečné se mohou vázat do cyklických struktur za tvorby metafosforečných kyselin. Nejjednodušším případem je kyselina trimetafosforečná se vzorcem H3P3O9 (viz obrázek výše). Při každé kondenzaci se uvolní molekula vody (H2O). Přestože jsou tyto kyseliny obecně nazývány trimetafosforečnými, tak mohou ve skutečnosti mít různé struktury. Obecný sumární vzorec je (HPO3)x, kde x označuje počet fosforečnanových jednotek v molekule. Teoretickým monomerem těchto kyselin je kyselina monometafosforečná (monohydrogenfosforečná), HPO3, která by byla isoelektronová s kyselinou dusičnou, dosud však nebyla izolována, a to ani ve formě soli.
Deprotonací cyklických polyfosforečných kyselin vznikají cyklické (meta)fosforečnanové anionty. Příkladem soli takového aniontu je hexametafosforečnan sodný (Na6P6O18), používaný jako sekvestrant a potravinářská přídatná látka.
Estery
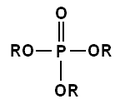
Hydroxylové skupiny v molekulách (poly)fosforečných kyselin mohou také kondenzovat s hydroxylovými skupinami alkoholů a fenolů za vzniku příslušných organofosfátových esterů. Kyselina trihydrogenfosforečná má tři hydroxyly a tak může tvořit mono-, di- a triestery. Esterifikace může probíhat i u polyfosforečných kyselin. V závislosti na pH roztoku může odštěpit vodíkový kation kterákoliv z hydroxylových skupin. V živých organismech se vyskytuje velké množství derivátů mono-, di- a trifosforečných kyselin (většinou esterů); řada z nich, jako například adenosindifosfát (ADP) a adenosintrifosfát (ATP) má velký význam v metabolismu.
R může být H
nebo organický substituent.
Odkazy
Související články
- Adenosinmonofosfát
- Adenosindifosfát
- Adenosintrifosfát
- Adenosintetrafosfát
- Nukleosidtrifosfát
- Organofosfáty
- Kyselina fosfonová
- Fosforamidáty
- Ribonukleosidmonofosfát
Reference
V tomto článku byl použit překlad textu z článku Phosphoric acids and phosphates na anglické Wikipedii.
- ↑ Laurence M. Harwood; Leslie C. Hodgkinson; James K. Sutherland; Patrick Towers. Synthesis of anthracyclinones. Part 1. Regioselective alkylation of 5-hydroxyquinizarin. Canadian Journal of Chemistry. 1984, s. 1922–1925. DOI 10.1139/v84-329.
- ↑ Koichi Nakazawa; Shin Matsuura; Kosuke Kusuda. Studies on the Application of Polyphosphoric Acid as a Condensing Agent. II. Yakugaku Zasshi. 1954, s. 495–497. DOI 10.1248/yakushi1947.74.5_495.
Média použitá na této stránce
Structure of diphosphoric acid
Chemical Structures of Various Phosphoric Acids The following chemical structures are shown in this image:
- orthophosphoric acid
- pyrophosphoric acid
- tripolyphosphoric acid
- tetrapolyphosphoric acid
- trimetaphosphoric acid
- phosphoric anhydride P4O10
H Padleckas created this image file on October 21-22, 2005 especially for use in the article "Phosphoric Acids and Phosphates" in Wikipedia. H Padleckas 06:00, 23 October 2005 (UTC)
In November 2006, H Padleckas modified this image to revise the appearance of the P4O10 molecular strucure. H Padleckas 20:52, 21 November 2006 (UTC)Phosphorus-pentoxide-3D-vdW