Polymerizace s otevíráním kruhu

Polymerizace s otevíráním kruhu je řetězcová polymerizace, při které se polymerní řetězec prodlužuje reakcemi s cyklickými monomery. Reaktivní centrum může být radikálové, aniontové, nebo kationtové povahy. Z některých cyklických monomerů, například norbornenu a cyklooktadienu, lze za katalýzy kovy získat polymery o vysokých molekulových hmotnostech. Jsou vhodné i pro přípravu biopolymerů.
Otevírání kruhu cyklických monomerů je často řízeno uvolněním kruhového napětí, změna entalpie při otevírání kruhu je záporná.[1]
Monomery
K cyklickým monomerům, které se mohou účastnit polymerizací s otevíráním kruhu, patří epoxidy, cyklické trisiloxany, laktony, laktidy, cyklické karbonáty a N[2][3][4][5] a cykloalkeny s velkým kruhovým napětím, jako je norbornen.
Historie
První polymerizace s otevíráním kruhu byly popsány na začátku 20. století; v roce 1906 byla provedena umělá syntéza peptidů[6] a nedloouho poté byly tímto způsobem z anhydrosacharidů získány polysacharidy, například dextran, xanthan, welan, gelan, diutan a pullulan. Mechanismy a termodynamika polymerizací tohoto druhu byly nalezeny v 50. letech 20. století.[7][8]
První vysokomolekulární polymery (o Mn až 105) byly polymerizacemi s otevíráním kruhu vytvořeny v roce 1976.[9][10]
V průmyslu se tento druh polymerizace využívá například na výrobu nylonu 6.
Mechanismy
Polymerizace s otevíráním kruhu mohou probíhat radikálově, aniontově, nebo kationtově.[11]
Radikálové varianty jsou využitelné pro přípravu polymerů se zabudovanými funkčními skupinami, například etherovými, esterovými, amidovými, a karbonátovými, které nelze vytvořit běžnými postupnými polymerizacemi vinylových monomerů.[11][12]
Aniontové polymerizace s otevíráním kruhu

Aniontové polymerizace s otevíráním kruhu jsou iniciovány nukleofilními činidly. Tímto způsobem se polymerizují tříčlenné cykly, jako jsou epoxidy, aziridiny a episulfidy.[12]
Příkladem reakce může být polymerizace ε-kaprolaktonu, iniciovaná alkoxidem.[12]
Kationtové polymerizace s otevíráním kruhu
Při kationtových polymerizacích s otevíráním kruhu se využívají kationtové iniciátory a vznikají kationtové meziprodukty. K cyklickým sloučeninám polymerizovaným tímto mechanismem patří laktony, laktamy, aminy a ethery.[13] Propagace je řetězcová a může probíhat SN1 nebo SN2 mechanismem.[11] Na mechanismus má vliv stabilita vznikajících kationtů; pokud je kladně nabitý atom stabilizován skupinou dodávající elektrony, tak bude převažovat SN1 mechanismus;[12] náboj se vytváří na heteroatomu.

Monomery lze aktivovat Brønstedovými kyselinami, karbeniovými nebo oniovými ionty, nebo kationty kovů.[11]
Kationtové polymerizace s otevíráním kruhu lze provádět jako živé a terminovat nukleofily, jako jsou fenoxy anionty, fosfiny, nebo polyanionty.[11] Po vyčerpání monomeru může nastat vnitromolekulární nebo mezimolekulární terminace. Aktivní konec může propojit několik cyklů a vytvořit tak makrocyklus. Může také proběhnout přenos alkylového řetězce, kdy je aktivní konec deaktivován přenosem alkylové skupiny na jinou polymerní molekulu.
Polymerizace metatezí s otevíráním kruhu
Polymerizace metatezí s otevíráním kruhu vytváří nenasycené polymery z cykloalkenů a bicykloalkenů; nutné jsou při nich organokovové katalyzátory.[11]
Mechanismus polymerizací metatezí s otevíráním kruhu je podobný jako u metatezí alkenů. Iniciace spočívá v koordinaci cykloalkenu na alkylidenový komplex kovu, po kterém následuje [2+2] cykloadice, jíž vzniká metalacyklobutanový meziprodukt, který se přeměňuje na nový alkyliden.[15][16]
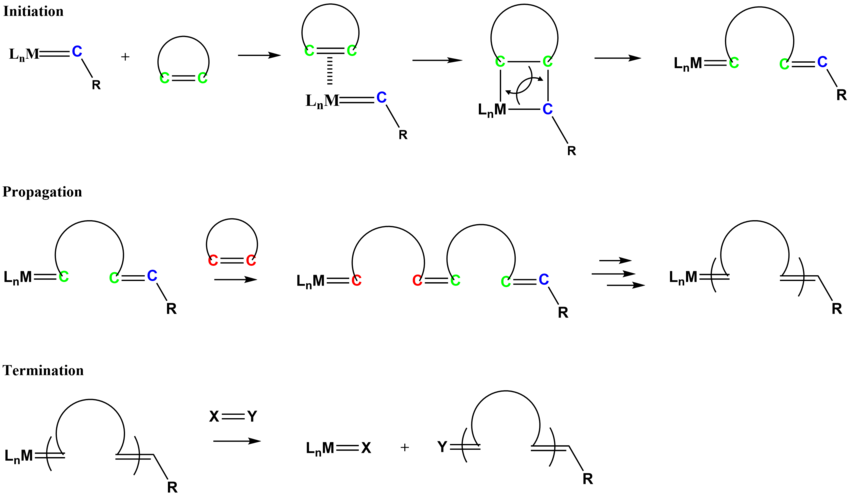
K významným nenasyceným polymerům vyráběným polymerizací metatezí s otevíráním kruhu patří Norsorex (polynorbornen), Vestenamer (polycyklookten) a Metton (polycyklopentadien).[17][18]
Termodynamika
Gibbsova volná energie polymerizace se dá vyjádřit jako:
kde x označuje monomer a y polymer (x a/nebo y = l (kapalina), g (plyn), c (amorfní pevná látka), c’ (krystalická pevná látka), s (roztok)), ΔHp(xy) a ΔSp(xy) jsou odpovídající entalpie (v jednotce joule) a entropie (joule na kelvin) polymerizace a T je absolutní teplota (v kelvinech).
Volná entalpie polymerizace (ΔGp) může být vyjádřena pomocí součtu standardní entalpie polymerizace (ΔGp°) a parametru zahrnujícího okamžitou koncentraci monomeru i narůstajícího polymeru:
kde R je molární plynová konstanta, M monomer, (m)i monomer v původním stavu, a m* aktivní monomer. Podle Floryovy–Hugginsovy teorie roztoku reaktivita aktivního centra, nacházejícího se na dostatečně dlouhé makromolekule, nezáleží na jejím stupni polymerizace a skutečnosti, že ΔGp° = ΔHp° - TΔSp° (kde ΔHp° je standardní entalpie a ΔSp° standardní entropie polymerizace), vychází:
Při dosažení rovnováhy (ΔGp = 0), kdy je polymerizace hotová, lze koncentraci monomeru ([M]eq) vyjádřit pomocí standardních parametrů polymerizace (ΔHp° a ΔSp°) a teploty při reakci:
Polymerizace může probíhat pouze tehdy, když je [M]0 větší než [M]eq. Teplota, při které je [M]eq rovno [M]0 a postup polymerizace se tak zastaví, se nazývá teplota depolymerizace a značí (Tc);
například tetrahydrofuran se nemůže polymerizovat za teploty nad 84 °C a cyklooktasíra (S8) pod 159 °C.[19][20][21][22] U většiny monomerů dochází při polymerizaci ke snížení entropie. Taková polymerizace je termodynamicky možná pouze tehdy, když převáží vliv entalpie na ΔGp (jestliže ΔHp° < 0 a ΔSp° < 0, tak musí být splněna nerovnost |ΔHp| > -TΔSp). Čím větší je kruhové napětí tím menší je tak koncentrace monomeru při dosažení rovnováhy.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Ring-opening polymerization na anglické Wikipedii.
- ↑ YOUNG, Robert J. Introduction to Polymers. Boca Raton: CRC Press, 2011. ISBN 978-0-8493-3929-5.
- ↑ C. Jerome; P. Lecomte. Recent advances in the synthesis of aliphatic polyesters by ring-opening polymerization. Advanced Drug Delivery Reviews. 2008-06-10, s. 1056–1076. Dostupné online. ISSN 0169-409X. doi:10.1016/j.addr.2008.02.008. PMID 18403043.
- ↑ Yann Sarazin; Jean-François Carpentier. Discrete Cationic Complexes for Ring-Opening Polymerization Catalysis of Cyclic Esters and Epoxides. Chemical Reviews. 2015, s. 3564–3614. doi:10.1021/acs.chemrev.5b00033. PMID 25897976.
- ↑ Julie M. Longo; Maria J. Sanford; Geoffrey W. Coates. Ring-Opening Copolymerization of Epoxides and Cyclic Anhydrides with Discrete Metal Complexes: Structure–Property Relationships. Chemical Reviews. 2016, s. 15167–15197. doi:10.1021/acs.chemrev.6b00553. PMID 27936619.
- ↑ H. R. Kricheldorf. Polypeptides and 100 Years of Chemistry of Α-Amino Acid N-Carboxyanhydrides. Angewandte Chemie International Edition. 2006, s. 5752–5784. doi:10.1002/anie.200600693. PMID 16948174.
- ↑ H. Leuchs. Glycine-carbonic acid. Berichte der Deutschen Chemischen Gesellschaft. 1906, s. 857. Dostupné online. doi:10.1002/cber.190603901133.
- ↑ F. S. Dainton; T. R. E. Devlin; P. A. Small. The thermodynamics of polymerization of cyclic compounds by ring opening. Transactions of the Faraday Society. 1955, s. 1710. doi:10.1039/TF9555101710.
- ↑ André Conix; G. Smets. Ring opening in lactam polymers. Journal of Polymer Science. 1955, s. 221–229. doi:10.1002/pol.1955.120157918. Bibcode 1955JPoSc..15..221C.
- ↑ Krzysztof Kałuz̀ynski; Jan Libiszowski; Stanisław Penczek. Poly(2-hydro-2-oxo-1,3,2-dioxaphosphorinane). Preparation and NMR spectra. Die Makromolekulare Chemie. 1977, s. 2943–2947. ISSN 0025-116X. doi:10.1002/macp.1977.021781017.
- ↑ Jan Libiszowski; Krzysztof Kałuz̀ynski; Stanisław Penczek. Polymerization of cyclic esters of phosphoric acid. VI. Poly(alkyl ethylene phosphates). Polymerization of 2-alkoxy-2-oxo-1,3,2-dioxaphospholans and structure of polymers. Journal of Polymer Science: Polymer Chemistry Edition. 1978, s. 1275–1283. ISSN 0025-116X. doi:10.1002/pol.1978.170160610. Bibcode 1978JPoSA..16.1275L.
- ↑ a b c d e f Oskar Nuyken; Stephen D. Pask. Ring-Opening Polymerization—An Introductory Review. Polymers. 2013-04-25, s. 361–403. doi:10.3390/polym5020361.
- ↑ a b c d e Philippe Dubois. Handbook of ring-opening polymerization. Weinheim: Wiley-VCH ISBN 978-3-527-31953-4.
- ↑ John McKenzie Grant Cowie. Polymers: Chemistry and Physics of Modern Materials. [s.l.]: CRC Press, 2008. ISBN 978-0-8493-9813-1. S. 105–107.
- ↑ PRUCKMAYR, Gerfried; DREYFUSS, P.; DREYFUSS, M. P. Kirk‑Othmer Encyclopedia of Chemical Technology. Polyethers, Tetrahydrofuran and Oxetane Polymers. [s.l.]: John Wiley & Sons, 1996.
- ↑ Sutthira Sutthasupa; Masashi Shiotsuki; Fumio Sanda. Recent advances in ring-opening metathesis polymerization, and application to synthesis of functional materials. Polymer Journal. 2010-10-13, s. 905–915. doi:10.1038/pj.2010.94.
- ↑ John F. Hartwig. Organotransition metal chemistry : from bonding to catalysis. Sausalito, California: University Science Books, 2010. Dostupné online. ISBN 9781891389535.
- ↑ Jennifer A. Love; John P. Morgan; Tina M. Trnka; Robert H. Grubbs. A Practical and Highly Active Ruthenium-Based Catalyst that Effects the Cross Metathesis of Acrylonitrile. Angewandte Chemie International Edition. 2002-11-04, s. 4035–4037. ISSN 1433-7851. doi:10.1002/1521-3773(20021104)41:21<4035::aid-anie4035>3.0.co;2-i. PMID 12412073.
- ↑ Dylan J. Walsh; Sii Hong Lau; Michael G. Hyatt; Damien Guironnet. Kinetic Study of Living Ring-Opening Metathesis Polymerization with Third-Generation Grubbs Catalysts. Journal of the American Chemical Society. 2017-09-25, s. 13644-13647. ISSN 0002-7863. doi:10.1021/jacs.7b08010. PMID 28944665.
- ↑ TOBOLSKY, A. V. Equilibrium polymerization in the presence of an ionic initiator. Journal of Polymer Science. July 1957, s. 220–221. doi:10.1002/pol.1957.1202510909. Bibcode 1957JPoSc..25..220T.
- ↑ TOBOLSKY, A. V. Equilibrium polymerization in the presence of an ionic initiator. Journal of Polymer Science. August 1958, s. 126. doi:10.1002/pol.1958.1203112214. Bibcode 1958JPoSc..31..126T.
- ↑ TOBOLSKY, Arthur V.; EISENBERG, ADI. Equilibrium Polymerization of Sulfur. Journal of the American Chemical Society. May 1959, s. 780–782. doi:10.1021/ja01513a004.
- ↑ TOBOLSKY, A. V.; EISENBERG, A. A General Treatment of Equilibrium Polymerization. Journal of the American Chemical Society. January 1960, s. 289–293. doi:10.1021/ja01487a009.
Literatura
- LUCK. Expanding Monomers: Synthesis, Characterization, and Applications. Boca Raton, Florida: CRC Press, 1992. ISBN 9780849351563.
- SUGIYAMA, J.; R. NAGAHATA; M. GOYAL; M. ASAI; M. UEDA; K. TAKEUCHI. ACS Polymer Preprints. 1998, s. 90.
- Nikos Hadjichristidis, Hermis Iatrou, Marinos Pitsikalis, Georgios Sakellariou. Synthesis of Well-Defined Polypeptide-Based Materials via the Ring-Opening Polymerization of α-Amino Acid N-Carboxyanhydrides. Chemical Reviews. 2009, s. 5528–5578. doi:10.1021/cr900049t. PMID 19691359.
- Nahrain E. Kamber, Wonhee Jeong, Robert M. Waymouth, Russell C. Pratt, Bas G. G. Lohmeijer, James L. Hedrick. Organocatalytic Ring-Opening Polymerization. Chemical Reviews. 2007, s. 5813–5840. doi:10.1021/cr068415b. PMID 17988157.
- MATSUMURA, Shuichi; TSUKADA, KEISUKE; TOSHIMA, KAZUNOBU. Enzyme-Catalyzed Ring-Opening Polymerization of 1,3-Dioxan-2-one to Poly(trimethylene carbonate). Macromolecules. May 1997, s. 3122–3124. doi:10.1021/ma961862g. Bibcode 1997MaMol..30.3122M.
Související články
Média použitá na této stránce
Autor: Mr.Holmium, Licence: CC BY-SA 3.0
Ionic (cationic or anionic) or radical propagation of ROP.
Autor: Chakyoun, Licence: CC BY-SA 3.0
The general mechanism for anionic ring-opening polymerization. Polarized functional group is represented by X-Y, where the atom X (usually a carbon atom) becomes electron deficient due to the highly electron-withdrawing nature of Y (usually an oxygen, nitrogen, sulfur, etc.). The nucleophile will attack atom X, thus releasing Y-. The newly formed nucleophile will then attack the atom X in another monomer molecule, and the sequence would repeat until the polymer is formed (Dubois).



