Polymorfie
Polymorfie (dříve mnohotvarost) je schopnost látek krystalovat ve více krystalových strukturách. Konkrétní krystalovou strukturu polymorfní látky nazýváme polymorf. Polymorfie prvků se nazývá alotropie. Polymorfie se zahrnutím rozpouštědla v krystalové mřížce se nazývá solvatomorfie. Výrazy jako dimorfie nebo trimorfie se používají ke zdůraznění, že mohou existovat pouze dvě respektive tři krystalové formy.
Příkladem polymorfie může být uhlík, který tvoří několik alotropických modifikací:
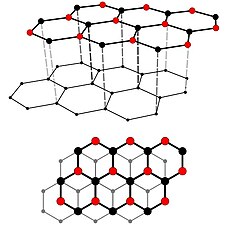
Grafit (tuha) je nejběžnější forma uhlíku a má tvrdost 1 až 2 na Mohsově stupnici tvrdosti.
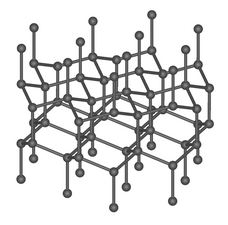
Diamant je druhá základní forma uhlíku a nejtvrdší přírodní minerál (10 na Mohsově stupnici tvrdosti, absolutní tvrdost je asi 1600× větší než tvrdost 1 na této stupnici).
- (c) Mstroeck, CC BY-SA 3.0
Lonsdaleit je vzácná přírodní alotropní modifikací uhlíku. Krystalová struktura je podobná diamantu, krystalografická soustava je však šesterečná.
Grafen tvoří jedna či několik málo vrstev rovinné sítě vzájemně propojených atomů uhlíku ve tvaru šestiúhelníků. Má mimořádné fyzikální vlastnosti a očekává se mnohostranné využití.
Fullereny: atomy jsou uspořádány do sférických molekul tvořených šestiúhelníky a pětiúhelníky. Fullereny jsou mimořádně odolné vůči vnějším fyzikálním vlivům.
Historie
Polymorfy se mohou vzájemně přeměňovat při určitých teplotách a mívají rozdílné fyzikálně-chemické vlastnosti, zejména body tání, rozpustnost a charakteristicky difraktují v rentgenovém záření.
Krystalizace je ovlivněna faktory jako vliv rozpouštědla, přesycení, čistota, teplota a tlak, intenzita míchání, které mohou ale nemusí rozhodovat, ve které polymorfní formě bude látka krytalizovat.
První pozorování polymorfie se přičítá Fridrichu Wöhlerovi a Justu von Liebigovi, když v roce 1832 zkoumali benzamid[1] a z chladnoucího nasyceného roztoku jim nejprve krystalizovaly jehličky, které se postupně přeměňovaly na klencové krystalky.
Polymorfie se velmi těžko předpovídá a nelze nijak prokázat, že látka netvoří další polymorfy. V roce 2006 byl objeven nový polymorf maleinové kyseliny po 124 letech od její první krystalografické analýzy.[2]
Farmakologie
Patentová ochrana léčiv je vázaná na technologii a konkrétní polymorf léčivé látky, definovaný práškovým difraktogramem. Jiná společnost si může patentovat jiný polymorf a místo náročných klinických testů stačí pouze dokázat ekvivalentní biodostupnost a neexistenci nových vedlejších účinků léčiva. Proto patentování léčiva většinou předchází screening.
Užití v geochemii
Využívá se pro horninotvorné minerály, jejichž distribuce a forma může být funkcí teploty a tlaku.
Jedna sloučenina tak vlivem odlišných podmínek vytváří jiné krystaly, např. uhličitan vápenatý (CaCO3) vytváří aragonit a kalcit a nebo podobně železo – hořčík se chová v pyroxenech, či granátech.
Kalcit je nejběžnější forma uhličitanu vápenatého, krystalografická soustava je klencová, tvrdost 3 na Mohsově stupnici tvrdosti.
Aragonit, krystalografická soustava je kosočtvercová, tvrdost 3,5 až 4 na Mohsově stupnici tvrdosti.
Reference
- ↑ F. Wöhler, J. Liebig, Ann. Pharm. 1832, 3, 249 – 282. DOI:10.1002/jlac.18320030302
- ↑ Graeme M. Day, Andrew V. Trask, W. D. Samuel Motherwell and William Jones. Investigating the latent polymorphism of maleic acid. Chemical Communications. 2006, s. 54–56. DOI 10.1039/b513442k. PMID 16353090. (anglicky)
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu polymorfie na Wikimedia Commons
Obrázky, zvuky či videa k tématu polymorfie na Wikimedia Commons
Média použitá na této stránce
Autor: Didier Descouens, Licence: CC BY 4.0
Aragonite
- locality : Retamal ravine, Enguidanos, Cuenca, Castile-La Mancha, Spain
- Size 7.6 x 6.1 x 5.7 cm
Diamond crystal structure consists of a face centered cubic lattice, each edge measures 3.6 Å.
(c) Mstroeck, CC BY-SA 3.0
Mstroeck, držitel autorských práv k tomuto dílu, ho tímto zveřejňuje za podmínek následující licence:
Autor: Koreller, Licence: CC BY-SA 4.0
Calcite, en provenance de Fontainebleau (Seine-et-Marne, France), au Muséum de Nantes