Pyranosa
Pyranóza nebo pyranosa je souhrnné označení pro monosacharidy, které mají cyklickou strukturu tvořenou pěti uhlíkovými a jedním kyslíkovým atomem. Na tento kruh mohou být připojeny další atomy uhlíku (u více než pětiuhlíkatých monosacharidů). Název je odvozen od jejich podobnosti s kyslíkatým heterocyklem pyranem, ovšem pyranózový kruh neobsahuje dvojné vazby a podobá se tak spíše tetrahydropyranu. Tyto formy vznikají hlavně u hexóz a heptóz. Pyranóza, u níž byl anomerický hydroxyl (na prvním uhlíku) přeměněn na OR-skupinu, se nazývá pyranosid.
| Tetrahydropyran | |||
| Název | Tetrahydropyran | α-D-Glukopyranóza | |
| Strukturní vzorec |  |  | |
| Tetrahydropyranový kruh zvýrazněn modře | Tetrahydropyranový kruh zvýrazněn modře | ||
Tvorba
Pyranózový kruh se tvoří reakcí hydroxylové skupiny na pátém uhlíku s aldehydovou skupinou na prvním uhlíku, čímž vzniká vnitromolekulární poloacetal. Pokud reakce proběhne mezi aldehydem a hydroxylem na čtvrtém uhlíku, vznikne furanóza.[1] Pyranózová forma je termodynamicky stabilnější než furanózová forma a tak v roztoku převažuje.[2]

Historie
Hermann Emil Fischer získal v roce 1902 Nobelovu cenu za chemii za jeho práci na určení struktury D-aldohexóz[1], ovšem lineární, nealdehydové struktury, které navrhl, tvoří jen nepatrná část molekul hexózových sacharidů v roztoku. Až Edmund Hirst a Clifford Purves, ve výzkumné skupině Waltera Hawortha, přesvědčivě ukázali, že hexózy se vyskytují převážně v pyranózové formě, tedy v šestičlenném kruhu. Haworth nakreslil tento kruh jako šestiúhelník se skupinami nad a pod rovinou kruhu - vytvořil tak Haworthovu projekci.[3]
Konformace
Pyranózy mohou vytvářet celkem 38 různých konformací.[4]
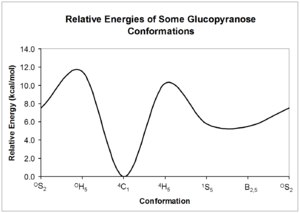
Konformace pyranóz jsou podobné jako u cyklohexanu.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Pyranosa na Wikimedia Commons
Obrázky, zvuky či videa k tématu Pyranosa na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Pyranose na anglické Wikipedii.
- ↑ a b Robyt, J.F. Essentials of Carbohydrate Chemistry. [s.l.]: Springer, 1998. ISBN 0-387-94951-8. (anglicky)
- ↑ Ma, B.Y.; SCHAEFER, H.F.; ALLINGER, N.L. Theoretical studies of the potential energy surfaces and compositions of the D-aldo and D-ketohexoses. Journal of the American Chemical Society. 1998, s. 3411–3422. DOI 10.1021/ja9713439. (anglicky)
- ↑ Rao, V.S.R.; QASBA, P.K.; CHANDRASEKARAN, R.; BALAJI, P.V. Conformation of Carbohydrates. [s.l.]: CRC Press, 1998. ISBN 90-5702-315-6. (anglicky)
- ↑ Ionescu, A.R.; BERCES, A.; ZGIERSKI, M.Z.; WHITFIELD, D.M.; NUKADA, T. Conformational Pathways of Saturated Six-Membered Rings. A Static and Dynamical Density Functional Study. The Journal of Physical Chemistry A. 2005, s. 8096–8105. DOI 10.1021/jp052197t. PMID 16834195. (anglicky)
Média použitá na této stránce
Relative energy of beta-D-glucopyranose conformers.
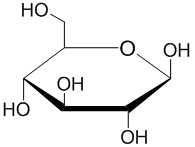
Representations of glucopyranose.




