Pyren
| Pyren | |
|---|---|
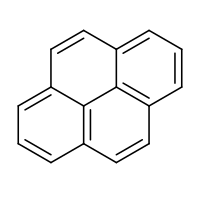 Strukturní vzorec | |
| Obecné | |
| Systematický název | Pyren, benzo[def]fenanthren |
| Sumární vzorec | C16H10 |
| Vzhled | bezbarvá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 129-00-0 |
| Vlastnosti | |
| Molární hmotnost | 202,25 g/mol |
| Teplota tání | 145–148 °C |
| Teplota varu | 404 °C |
| Rozpustnost ve vodě | 0,135 mg/l (ve vodě) |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | R36/37/38 R45 R53 |
| S-věty | (S24/25) (S26) (S36) |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Pyren je polycyklický aromatický uhlovodík (PAU), jehož molekula se skládá ze čtyř spojených benzenových kruhů v plochém aromatickém systému. Tato bezbarvá pevná látka je nejmenším těsně propojeným polycyklickým aromatickým uhlovodíkem – takovým, kde jsou benzenová jádra spojena více než jednou stranou. Pyren vzniká při nedokonalém spalování organických sloučenin.
Použití
Využití nachází v biochemickém výzkumu – jeho deriváty se používají jako molekulární sondy ve fluorescenční mikroskopii. Používá se také jako výchozí materiál při výrobě barviv a může sloužit jako donor elektronů čímž zvyšuje tmavost tuhy.[2]
Výskyt a reaktivita
Pyren byl poprvé izolován z uhelného dehtu, ve kterém tvoří až 2 % (hmotnostní).[3][4] Jakožto PAU s těsně propojenými benzenovými jádry je pyren mnohem více rezonančně stabilizován než jeho izomer fluoranthen s pětičlenným kruhem. Proto vzniká za širšího rozsahu podmínek spalování. Například automobily produkují přibližně 1 μg/km.[5]
Oxidace chromanem poskytuje perinaftenon a následně kyselinu naftalen-1,4,5,8-tetrakarboxylovou. Podléhá sérii hydrogenačních reakcí a je citlivý na halogenaci, Dielsovy–Alderovy adice a nitraci, vždy s proměnným stupněm selektivity.[5]
Bezpečnost
Přestože pyren není tak problematický jako benzo(a)pyren, studie prováděné na zvířatech ukázaly jeho toxicitu pro ledviny a játra. Také dráždí kůži a může způsobovat její chronické odbarvení.[6]
Reference
V tomto článku byl použit překlad textu z článku Pyrene na anglické Wikipedii.
- ↑ a b Pyrene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Griesbaum K et al. Ullmann's Encyclopedia of Industrial Chemistry 7th ed. (2008). NY, NY: John Wiley & Sons; Hydrocarbons. Online Posting Date: June 15, 2000.
- ↑ Warshawsky D; Patty's Toxicology CD-ROM (2005). NY, NY: John Wiley & Sons; Polycyclic and Heterocyclic Aromatic Hydrocarbons. Online Posting Date: April 16, 2001.
- ↑ IARC. Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Man. Geneva: World Health Organization, International Agency for Research on Cancer, 1972-PRESENT. (Multivolume work). Available at: http://monographs.iarc.fr/index.php Archivováno 23. 1. 2013 na Wayback Machine p. V32 432 (1983).
- ↑ a b Selim Senkan and Marco Castaldi "Combustion" in Ullmann's Encyclopedia of Industrial Chemistry, 2003 Wiley-VCH, Weinheim. Article Online Posting Date: March 15, 2003.
- ↑ Lewis, R.J. Sax's Dangerous Properties of Industrial Materials. 9th ed. Volumes 1-3. New York, NY: Van Nostrand Reinhold, 1996., p. 2830.
Literatura
- BIRKS, J. B. Photophysics of Aromatic Molecules. London: Wiley, 1969.
- VALEUR, B. Molecular Fluorescence: Principles and Applications. New York: Wiley-VCH, 2002.
- BIRKS, J.B. Eximers. london: Reports on Progress in Physics, 1975.
- FETZER, J. C. The Chemistry and Analysis of the Large Polycyclic Aromatic Hydrocarbons. New York: Wiley, 2000.
Externí odkazy
 Obrázky, zvuky či videa k tématu Pyren na Wikimedia Commons
Obrázky, zvuky či videa k tématu Pyren na Wikimedia Commons - (anglicky) Pyren na Chemical land21
- (anglicky) Pyren na PubChem
- (anglicky) Pyren na Toxnet
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances




