Pyridinové komplexy kovů

Pyridinové komplexy kovů jsou koordinační sloučeniny obsahující pyridinové ligandy. Na kovy se mohou koordinovat také mnohé deriváty pyridinu, například methylpyridiny a chinoliny.
Vazby
S pKa konjugované kyseliny 5,25 je pyridin přibližně 15krát slabší zásadou než imidazol. Pyridin je slabým pí-akceptorem. Délky vazeb M-N v komplexech [MCl2(py)4]2+ s rostoucím počtem d-elektronů u kovu klesají.[2] Počet známých pyridinových komplexů kovů v nízkých oxidačních číslech není velký.
Pyridin funguje jako Lewisova zásada i u prvků hlavní skupiny, příkladem mohou být komplexy SO3(py) a BH3py.
Rozdělení
Komplexy pyridinu lze dělit do skupin podle jejich geometrie, například na oktaedrické, tetraedrické a lineární.
Oktaedrické komplexy



Vzhledem k poměrně velkému úhlu C-N-C na sebe 2,6-vodíkové atomy navzájem působí za tvorby [M(py)6]z komplexů. Bylo popsáno několik homoleptických oktaedrických pyridinových komplexů. Takovéto komplexní ionty se vyskytují v solích [Ru(py)6]Fe4(CO)13 a [Ru(py)6](BF4)2.[3][4]
Některé sloučeniny se stechiometrickými vzorci M(py)6(ClO4)2 se lépe popisují jako [M(py)4(ClO4)2].(py)2[5]
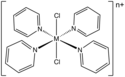
Časté jsou komplexy pyridinu typu [MCl2(py)4]n+. Chloridové ligandy jsou zde navzájem v poloze trans.
| Vzorec | Registrační číslo CAS | Důležité vlastnosti | Příprava | |
|---|---|---|---|---|
| TiCl2(pyridin)4 | 131618-68-3 | modrý, tripletový dTi-N=227 pm, dTi-Cl = 250 pm (solvatovanýtv THF)[6] | TiCl3(THF)3 + KC8 + py[7] | |
| VCl2(pyridin)4 | 15225-42-0 | růžový[8] | VCl3 + Zn + py[9] | |
| CrCl2(pyridin)4 | 51266-53-6 | zelený dCr-Cl = 280 pm dCo-Cl = 216 pm | CrCl2 + py[10] | |
| MnCl2(pyridin)4 | 14638-48-3 | 138,3 | ||
| FeCl2(pyridin)4 | 15138-92-8 | žlutý dFe-Cl = 243 pm | FeCl2 + py[2] | |
| CoCl2(pyridine)4 | 13985-87-0 | modrý dCo-Cl = 244 pm | CoCl2 + py[2] | |
| [CoCl2(pyridin)4]Cl | 27883-34-7 | zelený (hexahydrát) dCo-Cl = 225 pm, dCo-N = 198 pm[11] jako sůl [CoCl3(py)]− | CoCl2(pyridin)4 + Cl2[12] | |
| NiCl2(pyridin)4 | 14076-99-4 | modrý dNi-Cl = 244 pm | NiCl2 + py[2] | |
| NbCl2(pyridin)4 | 168701-43-7 | dNb-N = 222 pm, dNb-Cl = 251 pm | NbCl4(thf)2 + KC8 + py[6] | |
| [MoCl2py)4]Br3 | sůl Br3−[13] | žlutý dMo-Cl= 2.41 pm, dMo-N=220 pm | ||
| TcCl2py)4 | 172140-87-3 | růžový dTc-Cl = 241 pm, dTc-N = 210 pm[14] | TcCl4py2 + Zn + py | |
| RuCl2(pyridin)4 | 16997-43-6 | červenooranžový dRu-N=208 pm, dRu-Cl=240 pm | RuCl3(H2O)x + py [15] | |
| [RhCl2(pyridin)4]+ | 14077-30-6 (sůl Cl−) | žlutý | RhCl3(H2O)3 + py + katalytické redukční činidlo[16] | |
| OsCl2(pyridin)4 | 137822-02-7 | hnědý dOs-Cl = 240 pm, dOs-N= 206,8 pm | K3OsCl6 + py + (CH2OH)2/140 °C[17] | |
| [IrCl2(pyridin)4]+ | žlutý 135 pm (hexahydrát chloridu)[18] |
K M-Cl-py komplexům patří též tris(pyridin)trihalogenidy, například [MCl3(py)3] (M = Ti, Cr, Rh, Ir).[19]
4-koordinované komplexy

4-koordinované komplexy pyridinu mohou být tetraedrické či čtvercově rovinné. K homoleptickým tetraedrickým sloučeninám tohoto druhu patří [M(py)4]n+. kde Mn+ = Cu+,[20][21] Ni2+,[22]Ag+,[23] nebo Ag2+.[24]
Ke čtvercově rovinným homoleptickým komplexům patří d8 kationty [M(py)4]n+, kde Mn+ = Pd2+,[25] Pt2+[26] a Au3+.[27]
Ni(ClO4)2(3-pikolin)2 má dva izomery, žlutý a diamagnetický a čtvercově rovinný, a modrý, paramagnetický a tetraedrický.[28]
Manganaté a kobaltnaté ionty mohou, v závislosti na podmínkách, vytvářet jak tetraedrické komplexy druhu MCl2py2, tak i oktaedrické MCl2py4:[29]
- MCl2py2 + 2 py → MCl2py4
2- a 3-koordinované komplexy
Existuje řada komplexů [Au(py)2]+.[27] Známy jsou také [Ag(py)3]+ a [Cu(py)2]+.[30][27]
Pí-komplexy
Vazby typu η6, jaké jsou přítomny v η6 komplexech benzenu, byly pozorovány pouze u stericky zatížených derivátů, jejichž dusíkatá centra nejsou přístupná.[31]
Srovnání s ostatními ligandy
Pikoliny
Jako ligandy přechodných kovů mohou sloužit mnohé substituované deriváty pyridinu, například monomethylované pyridiny, nazývané pikoliny. 2-pikoliny se ze sterických důvodů do tvorby koordinačních sloučenin nezapojují.[28]
2,2'-bipyridin
Spojením dvou pyridinových kruhů v pozicích 2 vznikne 2,2'-bipyridin, fungující jako bidentátní ligand. Bipyridinové komplexy jsou v mnohém odlišné od pyridinových, například je znám velký počet komplexů [M(bipy)3]z, zatímco odpovídající komplexy [M(py)6]z jsou vzácné a bývají nestálé. Oxidační číslo bipyridinu je, například u sloučeniny [Cr(bipy)3]0, nestálé. Pyridinové obdoby tohoto komplexu nejsou známy. Dichlorokomplexy [MCl2(bipy)2]n+, například RuCl2(bipy)2 bývají typu cis, zatímco [MCl2(py)4]n+ jsou vždy trans.
Imidazoly
Další významnou skupinou N-heterocyklických ligandů jsou imidazoly. Oproti pyridinům se často vyskytují i v přírodě.
Použití a výskyt
Crabtreeův katalyzátor, používaný při hydrogenačních reakcích, je komplexem pyridinu.
I když nemají pyridinové komplexy přechodných kovů mnoho jiných využití, tak jsou častými syntetickými prekurzory. Mnohé z nich jsou bezvodé, rozpustné v nepolárních rozpouštědlech a náchylné k alkylacím organolithnými a Grignardovými činidly. Z CoCl2(py)4 se například připravují organokobaltové[32][33] a z NiCl2(py)4 organoniklové sloučeniny.[34]
Reference
V tomto článku byl použit překlad textu z článku Transition metal pyridine complexes na anglické Wikipedii.
- ↑ Yeung-gyo K. Shin; David J. Szalda; Bruce S. Brunschwig; Carol Creutz; Norman Sutin. Electronic and Molecular Structures of Pentaammineruthenium Pyridine and Benzonitrile Complexes as a Function of Oxidation State. Inorganic Chemistry. 1997, s. 3190–3197. DOI 10.1021/ic9700967. PMID 11669976.
- ↑ a b c d LONG, Gary J.; CLARKE, Peter J. Crystal and Molecular Structures of trans-Tetrakis(pyridine)dichloroiron(II), -Nickel(II), and -Cobalt(II) and trans-Tetrakis(pyridine)dichloroiron(II) Monohydrate. Inorganic Chemistry. 1978, s. 1394–1401. DOI 10.1021/ic50184a002. (anglicky)
- ↑ Joseph L. Templeton. Hexakis(pyridine)ruthenium(II) tetrafluoroborate. Molecular structure and spectroscopic properties. Journal of the American Chemical Society. 1979, s. 4906–4917. DOI 10.1021/ja00511a020.
- ↑ Crispin Lichtenberg; Mario Adelhardt; Michael Wörle; Torsten Büttner; Karsten Meyer; Hansjörg Grützmacher. Mono- and Dinuclear Neutral and Cationic Iron(II) Compounds Supported by an Amidinato-diolefin Ligand: Characterization and Catalytic Application. Organometallics. 2015, s. 3079–3089. DOI 10.1021/acs.organomet.5b00395.
- ↑ Dmitriy V. Soldatov; John A. Ripmeester. Hexapyridine Addition Compounds of Metal(II) Salts (Nickel and Magnesium Perchlorates, Magnesium Nitrate): Their Supramolecular Nature, and Anion Coordination of the Metal Cation [1]. Supramolecular Chemistry. 1998, s. 175–181. DOI 10.1080/10610279808034984.
- ↑ a b ARAYA, Miguel A.; COTTON, F. Albert; MATONIC, John H.; MURILLO, Carlos A. An Efficient Reduction Process Leading to Titanium(II) and Niobium(II): Preparation and Structural Characterization of trans-MCl2(py)4 Compounds, M = Ti, Nb, and Mn. Inorganic Chemistry. 1995, s. 5424–5428. DOI 10.1021/ic00126a009. (anglicky)
- ↑ WIJERATNE, Gayan B.; ZOLNHOFER, Eva M.; FORTIER, Skye; GRANT, Lauren N.; CARROLL, Patrick J.; CHEN, Chun-Hsing; MEYER, Karsten. Electronic Structure and Reactivity of a Well-Defined Mononuclear Complex of Ti(II). Inorganic Chemistry. 2015, s. 10380–10397. DOI 10.1021/acs.inorgchem.5b01796. PMID 26451744. (anglicky)
- ↑ BRAUER, D. J.; KRÜGER, C. Tetrapyridinedichlorovanadium(II). Crystal Structure Communications. 1973, s. 421. (anglicky)
- ↑ EDEMA, Jilles J. H.; STAUTHAMER, Walter; VAN BOLHUIS, Fre; GAMBAROTTA, Sandro; SMEETS, Wilberth J. J.; SPEK, Anthony L. Novel Vanadium(II) Amine Complexes: A Facile Entry in the chemistry of Divalent Vanadium. Synthesis and Characterization of Mononuclear L4VCl2 [L = Amine, Pyridine]: X-ray Structures of trans-(TMEDA)2VCl2 [TMEDA = N,N,N',N'-Tetramethylethylenediamine] and trans-Mz2V(py)2 [Mz = o-C6H4CH2N(CH3)2, py = Pyridine]. Inorganic Chemistry. 1990, s. 1302–1306. DOI 10.1021/ic00332a003. (anglicky)
- ↑ COTTON, F. Albert; DANIELS, Lee M.; FENG, Xuejun; MALONEY, David J.; MURILLO, Carlos A.; ZÚÑIGA, Luis A. Experimental and Theoretical study of a Paradigm Jahn-Teller Molecule, all-trans-CrCl2(H2O)2(pyridine)2, and the Related trans-CrCl2(pyridine)4·acetone. Inorganica Chimica Acta. 1995, s. 21–28. DOI 10.1016/0020-1693(95)90041-4. (anglicky)
- ↑ XU, Hao; LI, Jinyu; WU, Zhongzhi; ZOU, Jianzhong; XU, Zheng; YOU, Xiaozeng; DONG, Zhengchao. Synthesis and X-ray Crystal Structure of a Mixed-Valent Cobalt Complex, Co2Cl5(py)5. Polyhedron. 1993, s. 2261–2264. DOI 10.1016/S0277-5387(00)88265-0. (anglicky)
- ↑ GLERUP, Jørgen; SCHÄFFER, Claus Erik; SPRINGBORG, Johan. Synthesis of trans-Dichloro- and trans-Difluorotetrakis(pyridine)cobalt(III) Salts. Acta Chemica Scandinavica. 1978, s. 673–674. DOI 10.3891/acta.chem.scand.32a-0673. (anglicky)
- ↑ ROTAR, R.; LEBAN, I.; BRENČIČ, J. V. Trans-Dichlorotetrakis(pyridine-N)molybdenum(III) Tribromide. Acta Crystallographica Section C Crystal Structure Communications. 1996, s. 2155–2157. DOI 10.1107/S0108270196005628. (anglicky)
- ↑ BARRERA, Joseph; BURRELL, Anthony K.; BRYAN, Jeffrey C. Technetium(III), Technetium(II), and Technetium(I) Complexes with Pyridine Ligands. Can Pyridine Coordination Stabilize the Low Oxidation States of Technetium?. Inorganic Chemistry. 1996, s. 335–341. DOI 10.1021/ic950291q. PMID 11666213. (anglicky)
- ↑ WONG, W. T.; LAU, T. C. trans-Dichlorotetrapyridineruthenium(II). Acta Crystallographica Section C Crystal Structure Communications. 1994, s. 1406–1407. DOI 10.1107/S0108270194002088. (anglicky)
- ↑ GILLARD, R. D.; WILKINSON, G. W. trans-Dichlorotetra(pyridine)rhodium(III) Salts. [s.l.]: [s.n.], 1967. (Inorganic Syntheses; sv. 10). ISBN 9780470132418. DOI 10.1002/9780470132418.ch11. Kapitola Trans -Dichlorotetra(pyridine)Rhodium(III) Salts, s. 64–67. (anglicky)
- ↑ KOLF, S.; PREETZ, W. Darstellung, Kristallstrukturen, Schwingungsspektren und Normalkoordinatenanalysen der trans-Dihalogeno-tetrakis-Pyridin-Osmium(II)-Komplexe trans-[OsX2Py4], X = F, Cl, Br, I. Zeitschrift für anorganische und allgemeine Chemie. 1997, s. 501–508. DOI 10.1002/zaac.19976230179. (anglicky)
- ↑ GILLARD, R. D.; MITCHELL, Simon H.; WILLIAMS, Peter A.; VAGG, Robert S. The Structure of a Low-Temperature Form of trans-[Ir(pyridine)4Cl2]Cl. 6H2O. Journal of Coordination Chemistry. 1984, s. 325–330. DOI 10.1080/00958978408073886. (anglicky)
- ↑ K. R. Acharya; S. S. Tavale; T. N. Guru Row. Structure of mer-Trichlorotris(pyridine)rhodium(III), [RhCl3(C5H5N)3]. Acta Crystallographica Section C Crystal Structure Communications. 1984, s. 1327–1328. DOI 10.1107/S0108270184007848.
- ↑ a b J. C. Collins; W. W. Hess. Aldehydes from Primary Alcohols by Oxidation with Chromium Trioxide: Heptanal. Organic Syntheses. 1972, s. 5. DOI 10.15227/orgsyn.052.0005.
- ↑ Gordan Horvat; Tomislav Portada; Vladimir Stilinović; Vladislav Tomišić. Tetrapyridinecopper(I) hexafluoridophosphate(V). Acta Crystallographica Section E. 2007. DOI 10.1107/S1600536807024051.
- ↑ G. Liptay; T. Wadsten; A. Borbély-Kuszmann. Characterization of [Ni(py)4]Cl2 and its thermal decomposition. Journal of Thermal Analysis. 1986, s. 845–852. DOI 10.1007/BF01913555.
- ↑ Karin Nilsson; Åke Oskarsson; P.-A. Lund; Quang Shen; Johan Weidlein; V. P. Spiridonov; T. G. Strand. The Crystal Structure of Tetrapyridine Copper(I) Perchlorate and Tetrapyridine Silver(I) Perchlorate at 260 K. Acta Chemica Scandinavica. 1982, s. 605–610. DOI 10.3891/acta.chem.scand.36a-0605.
- ↑ George B. Kauffman; Richard A. Houghten; Robert E. Likins; Philip L. Posson; R. K. Ray. Tetrakis(Pyridine)Silver(2+)Peroxydisulfate. Inorganic Syntheses. 1998, s. 177–181. ISBN 9780470132630. DOI 10.1002/9780470132630.ch30.
- ↑ Robert Corbo; Dayne C. Georgiou; David J. D. Wilson; Jason L. Dutton. Reactions of [PhI(pyridine)2]2+ with Model Pd and Pt II/IV Redox Couples. Inorganic Chemistry. 2014, s. 1690–1698. DOI 10.1021/ic402836d. PMID 24409820.
- ↑ C. H. Wei; B. E. Hingerty; W. R. Busing. Structure of Tetrakis(pyridine)platinum(II) chloride trihydrate: Unconstrained anisotropic least-squares refinement of hydrogen and non-hydrogen atoms from combined X-ray–neutron diffraction data. Acta Crystallographica Section C Crystal Structure Communications. 1989, s. 26–30. DOI 10.1107/S0108270188009515.
- ↑ a b c Robert Corbo, Gemma F. Ryan, Mohammad A. Haghighatbin, Conor F. Hogan, David J. D. Wilson, Mark D. Hulett, Peter J. Barnard, Jason L. Dutton. Access to the Parent Tetrakis(pyridine)gold(III) Trication, Facile Formation of Rare Au(III) Terminal Hydroxides, and Preliminary Studies of Biological Properties. Inorganic Chemistry. 2016, s. 2830–2839. DOI 10.1021/acs.inorgchem.5b02667. PMID 26930516.
- ↑ a b L. M. Vallarino; W. E. Hill; J. V. Quagliano. Coordination Compounds of Nickel(II) Salts with Substituted Pyridines. Complexes of 2-, 3-, and 4-Methylpyridine. Inorganic Chemistry. 1965, s. 1598–1604. DOI 10.1021/ic50033a014.
- ↑ W. Libug; I. Uruska. The Relative Stability of Octahedral and Tetrahedral Complexes in Solution. I. Chloropyridine Complexes of Divalent Transition Metals. Inorganic Chemistry. 1966, s. 256–264. DOI 10.1021/ic50036a022.
- ↑ Wenbin Yang; Canzhong Lu; Honghui Zhuang. Hydrothermal Synthesis and Structures of Three New Copper Complexes: [{Cu(2,2′-bipy}2(β-Mo8O26)], [{Cu(py)3}2{Cu(py)2}2(α-Mo8O26)] and [Cu(py)2]4[(SO4)Mo12O36]. Journal of the Chemical Society, Dalton Transactions. 2002, s. 2879–2884. DOI 10.1039/b111480h.
- ↑ ELSCHENBROICH, C. Organometallchemie. 6th. vyd. [s.l.]: Vieweg & Teubner, 2008. ISBN 978-3-8351-0167-8. S. 524–525. (anglicky)
- ↑ Di Zhu; Femke F. B. J. Janssen; Peter H. M. Budzelaar. (Py)2Co(CH2SiMe3)2 as an Easily Accessible Source of CoR2. Organometallics. 2010, s. 1897–1908. DOI 10.1021/om901045s.
- ↑ Paul J. Chirik. Iron- and Cobalt-Catalyzed Alkene Hydrogenation: Catalysis with Both Redox-Active and Strong Field Ligands. Accounts of Chemical Research. 2015, s. 1687–1695. DOI 10.1021/acs.accounts.5b00134. PMID 26042837.
- ↑ Juan Cámpora; Marı́a Del Mar Conejo; Kurt Mereiter; Pilar Palma; Carmen Pérez; Manuel L. Reyes; Caridad Ruiz. Synthesis of Dialkyl, Diaryl and Metallacyclic Complexes of Ni and Pd Containing Pyridine, α-Diimines and Other Nitrogen Ligands. Journal of Organometallic Chemistry. 2003, s. 220–239. DOI 10.1016/S0022-328X(03)00691-0.
Média použitá na této stránce
Autor: LHcheM, Licence: CC BY-SA 3.0
Structure of Chloro(pyridine)cobaloxime, fixed coordinating bond
Sarett/Collins reagent
chemical structure of Crabtree's catalyst