Pyrimidin
| Pyrimidin | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | 1,3-diazin |
| Sumární vzorec | C4H4N2 |
| Identifikace | |
| Registrační číslo CAS | 289-95-2 |
| Vlastnosti | |
| Molární hmotnost | 80,08 g/mol |
| Teplota tání | 20 až 22 °C |
| Teplota varu | 123 až 124 °C |
| Hustota | 1,016 g.cm−3 |
| Rozpustnost ve vodě | mísitelný |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
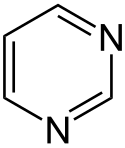
Pyrimidin je šestičlenná heterocyklická aromatická organická sloučenina podobná benzenu a pyridinu. Obsahuje dva atomy dusíku na pozicích 1 a 3 v šestičlenném kruhu. Název je odvozen od řeckého pyr (teplo, oheň) a sloučenin skupiny amidů. Podle systematického názvosloví je také nazýván 1,3-diazin.
Pyrimidin je izomerický se dvěma formami diazinu. Jsou to pyrazin (atomy dusíku na 1 a 4 pozici) a pyridazin (atomy dusíku na 1 a 2 pozici).
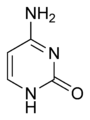
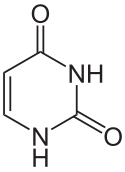
Deriváty pyrimidinu jsou tři nukleové báze, které se nacházející v nukleotidech nukleových kyselin. Jsou to cytosin (C), thymin (T) a uracil (U). Jsou to životně důležité látky, které se nalézají ve všech živých organismech a jsou nositeli jejich dědičných vlastností.
Vzorec pyrimidinu

Deriváty pyrimidinu
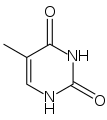
| Vzorec | Jméno | C2 | C4 | C5 | C6 |
|---|---|---|---|---|---|
| C4H5N3O | cytosin | =O | –NH2 | –H | –H |
| C4H4N2O2 | uracil | =O | =O | –H | –H |
| C4H3FN2O2 | fluorouracil | =O | =O | –F | –H |
| C5H6N2O2 | thymin | =O | =O | –CH3 | –H |
| C4H4N2O3 | kyselina barbiturová | =O | =O | –H | =O |
| C5H4N2O4 | kyselina orotová | =O | =O | –H | -COOH |
Nukleové báze
Nejdůležitějšími deriváty pyrimidinu jsou nukleové báze – cytosin, uracil, thymin. Dalšími nukleovými bázemi jsou deriváty odvozené z purinu – adenin, guanin.
- Cytosin (C)
- Thymin (T)
- Uracil (U)
Nukleové báze odvozené z pyrimidinu a purinu se v nukleových kyselinách obvykle vážou na ribózu (ribonukleová kyselina RNA) nebo na deoxyribózu (deoxyribonukleová kyselina DNA):
- v RNA se vyskytují čtyři báze: adenin (A), guanin (G), cytosin (C) a uracil (U)
- v DNA se vyskytují čtyři báze: adenin (A), guanin (G), cytosin (C) a thymin (T)
V nukleových kyselinách vytvářejí nukleové báze doplňkové dvojice (komplementární páry), v nichž se vždy jedna purinová a jedna pyrimidinová báze vzájemně vážou vodíkovými vazbami. Guanin se váže s cytosinem a adenin s thyminem nebo s uracilem. Tyto vazby tvoří kód k zápisu genetické informace v živých organismech. Komplementární párování pak umožňuje tuto informaci realizovat při procesech replikace, transkripce a translace.
Chemické vlastnosti
Chemické vlastnosti pyrimidinu se v mnohém shodují s pyridinem a benzenem. Jeho aromatický charakter způsobuje, že se snadno zúčastňuje elektrofilních a nukleofilních aromatických substitucí. Tedy reakcí, kdy elektrofil nebo nukleofil nahrazuje jinou skupinu navázanou na aromatické jádro. S narůstajícím počtem atomů dusíku v cyklu klesá energie π elektronů a elektrofilní aromatická substituce se stává mnohem obtížnější, zatímco nukleofilní aromatická substituce se stává snadnější.
Odkazy
Reference
V tomto článku byly použity překlady textů z článků Pyrimidin na německé Wikipedii a Pyrimidine na anglické Wikipedii.
- ↑ a b Pyrimidine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Pyrimidin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Pyrimidin na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Různé typy vzorců pyrimidinu.
Structure of pyrimidine
Autor: Cacycle (diskuse), Licence: CC BY-SA 3.0
Chemical structure of Cytosine. High-resolution b/w PNG; ChemDraw / Photoshop.
Pyrimidine