Racemizace
Racemizace je chemický proces, při němž se enantiomerně čistá (je přítomen pouze jeden enantiomer) látka mění na směs několika enantiomerů. Při racemizaci dojde k vytvoření stejného množství enantiomerů, vzniká tak racemická směs.[1][2]
Stereochemie
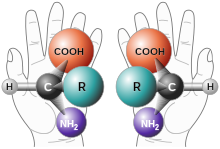
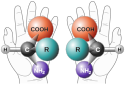
Chirální molekuly mají dvě formy (na každém chirálním centru), které se liší svými optickými vlastnostmi: (−) izomer stáčí rovinu polarizovaného světla doleva, zatímco (+) izomer ji stáčí doprava. Tyto dvě formy se nazývají enantiomery. Tato +/- notace by neměla být zaměňována s označováním D a L, které je odvozeno od struktury D- a L-glyceraldehydu.
Při racemizaci se jeden čistý enantiomer mění na stejná množství obou enantiomerů za vzniku racemické směsi. Je-li přítomno stejné množství (+) a (−) formy, pak k optické otáčivosti nedochází.[1] Enantiomery nejsou totéž jako diastereomery, druh stereoizomerů, které se liší strukturou molekuly kolem stereocentra, ale nejsou zrcadlovými obrazy.
Objev optické aktivity
Roku 1843 objevil Louis Pasteur optickou aktivitu u kyseliny parahroznové (racemické kyseliny vinné). Dokázal izolovat krystaly dvou enantiomerů, které otáčely rovinu polarozovaného světla opačným směrem.[2]
Vliv na fyzikální vlastnosti
Racemát má často odlišné fyzikální vlastnosti než každý jednotlivý enantiomer kvůli odlišným vnitromolekulárním interakcím. Přeměna z čistého enantiomeru na racemát může způsobit změnu hustoty, teploty tání, rozpustnosti, slučovacího tepla, indexu lomu a také různých spekter. Krystalizací racemické směsi mohou vzniknout oddělené (+) a (−) formy nebo jediná racemická látka.
Tvorba racemických směsí
Racemizace lze dosáhnout pouhým smísením stejných množství dvou čistých enantiomerů.
K racemizaci může dojít také během následujících procesů:
- Substituční reakce, při nichž vzniká karbokationtový meziprodukt, jako jsou jednomolekulární substituce, vedou k stereonespecifické adici substituentů, která vyústí v racemizaci.
- I když u jednomolekulárních eliminačních reakcí také vzniká karbokation, tak nedochází ke vzniku chirálních center. Místo toho se vytvoří několik geometrických izomerů v (E/Z) formách.
- Pokud při jednomolekulové alifatické elektrofilní substituci vzniká karbanion, který je rovinný nebo nemůže zůstat v pyramidální struktuře, pak někdy, ovšem ne vždy, proběhne racemizace.[3]
- Pokud při radikálové substituci vzniknou volné radikály na chirálním uhlíku, pak dojde téměř vždy k racemizaci.[4]
Racemizace v živých organismech
Většina biochemických reakcí je stereoselektivní, takže se jen jeden stereoizomer účastní reakce a druhý nereaguje nebo způsobuje vedlejší účinky; například u aminokyselin jsou obvykle biologicky aktivní L izomery a u sacharidů D-izomery.[5]
Datování tkání pomocí racemizace aminokyselin
Zjišťování míry racemizace L-forem na směs L- a D-forem je jednou z metod datování biologických vzorků ve tkáních s nízkou mírou obratu, forenzních vzorků a zkaměnělin, jelikož aminokyseliny po smrti (v některých tkáních, např. zubech, v omezené míře i během života) spontánně racemizují. Tato metoda se nazývá aminokyselinové datování. Touto metodou lze datovat vzorky staré až 120 tisíc let, ale ke spolehlivému určení je nutné znát přesné prostředí, ve kterém se vzorek nacházel, nebo jej porovnat s jiným vzorkem ze stejné lokality o známém stáří. Důvodem je velká závislost míry racemizace na podmínkách, kdy například v ostatcích uložených v půdě probíhá racemizace velmi pomalu a naopak zahřátí (např. vaření ostatků římského císaře Lothara III.) může proces násobně urychlit.[6]
Odkazy
Související články
Reference
V tomto článku byl použit překlad textu z článku Racemization na anglické Wikipedii.
- ↑ a b Streitwieser & Heathcock (1985) pp. 122–124
- ↑ a b NELSON, D. L.; COX, M. M. Lehninger Principles of Biochemistry. 6th. vyd. New York: W. H. Freeman, 2013. ISBN 1429234148.
- ↑ March (1985) pp. 517–518
- ↑ March (1985) p. 610
- ↑ VOET, D.; VOET, J. G.; PRATT, C. W. Fundamentals of Biochemistry: Life at the Molecular Level. 4th. vyd. Hoboken, NJ: John Wiley & Sons, 2013. ISBN 0470547847.
- ↑ OVAD, Tomáš; SLAVÍČEK, Petr. Homochirální život a racemická smrt: uvařený císař a jiné racemizační příběhy. Vesmír. 2024-09, roč. 103 (154), čís. 9, s. 486–487.
Média použitá na této stránce
Amino Acid Chirality chirality with hands from http://www.nai.arc.nasa.gov/ A "chiral" molecule is one that is not superposable with its mirror image. Like left and right hands that have a thumb, fingers in the same order, but are mirror images and not the same, chiral molecules have the same things attached in the same order, but are mirror images and not the same. Although most amino acids can exist in both left and right handed forms, Life on Earth is made of left handed amino acids, almost exclusively. No one knows why this is the case. However, Drs. John Cronin and Sandra Pizzarello have shown that some of the amino acids that fall to earth from space are more left than right. Thus, the fact that we are made of L amino acids may be because of amino acids from space. Why do amino acids in space favor L? No one really knows, but it is known that radiation can also exist in left and right handed forms. So, there is a theory called the Bonner hypothesis, that proposes that left handed radiation in space (from a rotating neutron star for example) could lead to left handed amino acids in space, which would explain the left handed amino acids in meteorites. This is still speculative but our paper makes it much more plausible. In fact, this observations was one of the main reasons why we pursued this research. Although there were theories about how the amino acids could form in space in the ice, no one had shown that it was viable to make amino acids this way, until now.