Radikálová substituce
Radikálové reakce nejsou běžné jako polární reakce, avšak jsou důležité při některých průmyslových procesech a v četných biologických procesech. Radikály jsou vysoce reaktivní, protože obsahují atom s lichým počtem elektronů (obvykle 7) ve valenční vrstvě, spíše než stabilní oktet. Radikál může dosáhnout oktetu několika způsoby. Například může vzít elektron z jiného reaktantu a přitom vznikne druhý radikál. Výsledkem je radikálová adice nebo substituce. Radikálová substituce je substituční reakce zahrnující volné radikály jako reaktivní meziprodukt.
Reakční mechanismus
Postupuje podle 3 kroků reakčního mechanismu: iniciace, propagace, terminace. [1]
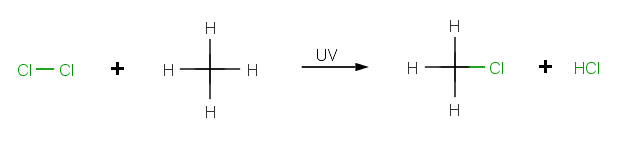
Příkladem může být reakce chlormethanu CH3Cl.
Iniciace
Ozáření ultrafialovým zářením začne reakci štěpením relativně slabé vazby Cl-Cl malého počtu molekul chloru Cl2 za vzniku reaktivních radikálů chloru • Cl. [1]
Propagace
Chloridové radikály napadají molekuly methanu odebírající radikálový atom vodíku za vzniku methylového radikálu • CH3. Tyto methylové radikály reagují s molekulou chloru ve druhém kroku propagace za vzniku chlormethanu a radikálu chloru. Tento cyklus se vrací k prvnímu kroku. Když je jednou tento sled spuštěn, udržuje se cyklus opakujících se kroků řetězové reakce. [2]
Terminace
Občas se stane, že se setkají 2 radikály a vytvoří tak stabilní produkt. Když se tak stane, cyklus je zastaven a řetězec ukončen. Tento krok není velmi častý, protože koncentrace v tomto okamžiku je velmi malá, takže šance, že se 2 radikály setkají je také velmi malá. [2]
Reakce
V radikálové substituci halogenů reagují radikály halogenů s uhlovodíky. K důležitým radikálovým substitucím patří i radikálové substituce arylů. Mnoho oxidací a redukcí v organické chemii je na principu radikálové substituce, např. oxidace aldehydů na karboxylové kyseliny za katalýzy kyselinou chromovou.
Některé významné reakce jsou:
- Bartonova–McCombieova deoxygenace je reakce, při které se substituuje hydroxylová skupina za vodík
- Wohlova–Zieglerova reakce zahrnuje bromace alkenů
- Hunsdieckerových reakce převádí stříbrné soli karboxylových kyselin na halogenderiváty
- Dowdova–Beckwithova reakce prodlužuje řetězec cyklických β-keto esterů
- Bartonova reakce zahrnuje syntézu nitroalkoholů z nitrilů
- Minisciova reakce zahrnuje tvorbu alkylového radikálu z karboxylové kyseliny a stříbrné soli a následnou substituci na aromatickou sloučeninu
Biologický význam
Příkladem radikálové substituce je syntéza vitamínu D, který se tvoří v kůži působením slunečního záření z provitamínu 7-dehydrocholesterolu, derivátu cholesterolu. Ultrafialové záření štěpí B jádro sloučeniny za vzniku cholekalciferolu, tedy vitamínu D3.
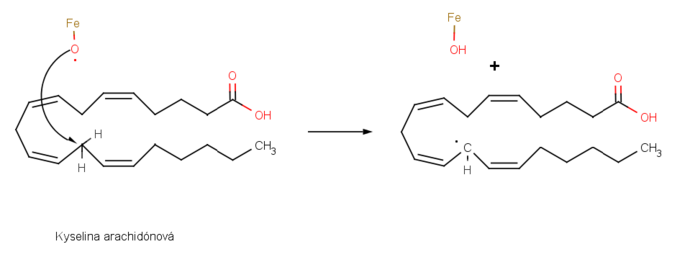
Jako příklad lze uvést také syntézu prostaglandinů- velké skupiny látek obsažených ve všech tkáních a tělních tekutinách. Množství léčiv je založených na derivátech prostaglandinů, například léky vyvolávající práci (posilující matku) při porodu, redukující nitrobuněčný tlak v glaukomu, kontrolující astma a kontrolující vrozené srdeční defekty. Biosyntéza prostaglandinu je iniciována odebráním vodíku kyselině arachidonové železno-kyslíkatými radikály generujícím nový uhlíkový radikál v radikálové substituci. [2]
Potom uhlíkový radikál reaguje s molekulou kyslíku O2 za vzniku kyslíkového radikálu, který reaguje s vazbou C=C téže molekuly. Některé další transformace vytvoří prostaglandin H2. [3]
Související články
- Elektrofilní adice
- Elektrofilní aromatická substituce
- Nukleofilní substituce
- Radikálová adice
- Eliminace
- Nukleofilní adice
Reference
V tomto článku byl použit překlad textu z článku Radikálová substitúcia na slovenské Wikipedii.
- ↑ a b MCMURRY, John. Organic chemistry. 6. vyd. [s.l.]: [s.n.] ISBN 978-80-214-3291-8. S. 140. (anglicky)
- ↑ a b c MCMURRY, John. Organic chemistry. 6. vyd. [s.l.]: [s.n.] ISBN 978-80-214-3291-8. S. 141. (anglicky)
- ↑ MCMURRY, John. Organic chemistry. 6. vyd. [s.l.]: [s.n.] ISBN 978-80-214-3291-8. S. 142. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Radikálová substituce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Radikálová substituce na Wikimedia Commons