Redukční eliminace
Redukční eliminace je reakce v organokovové chemii, při níž se oxidační číslo centrálního kovového atomu snižuje za tvorby nové kovalentní vazby mezi dvěma ligandy. Je mikroskopickým opakem oxidační adice a jedná se o produkt vytvářející krok v řadě katalytických procesů. Jelikož jsou oxidační adice a redukční eliminace opačné procesy, lze na ně aplikovat stejné mechanismy a rovnovážný stav záleží na elektrodynamice obou reakčních směrů.[1][2]
Základní vlastnosti
Redukční eliminace se často vyskytuje u vyšších oxidačních stavů a může spočívat v dvouelektronové přeměně na jednom kovovém centru (jednojaderná) nebo jednoelektronových přeměnách na dvou kovových centrech (dvoujaderná).[1][2]
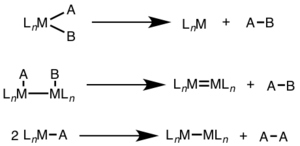
Při jednojaderné redukční eliminaci se oxidační číslo snižuje o 2 (přičemž se počet d-elektronů v atomu kovu o tento počet zvýší). Tento mechanismus je běžný u d8 kationtů (Ni2+, Pd2+ a Au3+) a d6 kationtů (Pt4+, Pd4+, Ir3+ a Rh3+). U jednojaderné redukční eliminace je nutné, aby skupiny, které mají být redukovány, byly v cis-poloze vzhledem k dalšímu kovovému centru.[3]

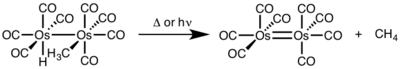
V dvojjaderné redukční eliminaci se oxidační číslo každého kovového atomu snižuje o 1 a o tuto hodnotu se zvyšuje počet d-elektronů v každém z těchto atomů. Takovýto mechanismus se objevuje hlavně u kovů první řady přechodných kovů, které upřednostňují jednotkovou změnu oxidačního čísla, i když byl pozorován i u druhé a třetí řady.[4]
Mechanismus
Podobně jako oxidační adice může redukční eliminace probíhat několika různými mechanismy. Převažuje koncentrovaný mechanismus, kdy vzniká nepolární, tricentrický přechodný stav s neměnící se stereochemií. Může se také objevit SN2 mechanismus či radikálový mechanismus, při němž se změní stereochemie.[1]
Osmistěnné komplexy
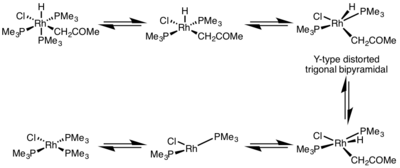
Výtěžnost redukční eliminace bývá silně ovlivněna geometrií kovového komplexu. U osmistěnných komplexů probíhá velmi pomalu a často pouze disociačním mechanismem, kde ligand musí disociovat komplex s koordinačním číslem 5. Tento komplex zaujímá tvar pokřivené trigonální bipyramidy typu Y, kde je π donorový ligand v základní pozici a dvě skupiny, které mají být eliminovány, jsou velmi blízko k sobě. Po eliminaci se vytvoří komplex s koordinačním číslem 3, který se spojuje s ligandem za vzniku rovinného čtvercového komplexu, jehož koordinační číslo je 4.[5]
Čtvercové rovinné komplexy
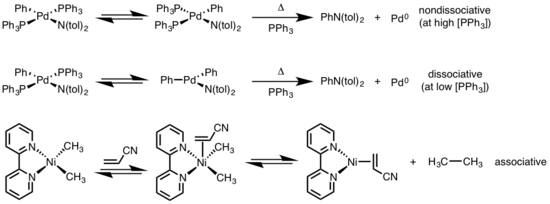
Redukční eliminace čtvercových rovinných komplexů může probíhat několika způsoby: Disociačně, nedisociačně a asociativně. Podobně jako u osmistěnných komplexů zde mechanismus začíná ztrátou ligandu za vzniku meziproduktu s koordinačním číslem 3, který prochází redukční eliminací za tvorby komplexu s koordinačním číslem 1. U nedisociačního mechanismu se tvoří meziprodukt s koordinačním číslem 4 a výsledný produkt s koordinačním číslem 2. Pokud jsou eliminující ligandy vůči sobě v pozici trans, musí se nejprve komplex přeměnit na cis. V případě asociativního mechanismu se ligand nejdříve musí spojit s komplexem s koordinačním číslem 4, čímž se koordinační číslo zvýší na 5 a takovýto komplex poté prochází redukční eliminací podle disociačního mechanismu pro osmistěnné komplexy.[6][7]
Faktory, které ovlivňují redukční eliminaci
Na redukční eliminaci má vliv několik faktorů: druh kovu a elektronová hustota, prostorové uspořádání, zúčastněné ligandy, koordinační číslo, geometrie komplexů a fotolýza/oxidace.
Druh kovu a elektronová hustota
U komplexů přechodných kovů z první řady probíhá redukční eliminace rychleji, než u komplexů kovů druhé řqady, u nichž je zase rychlejší než u komplexů kovů třetí řady; tato vlastnost je způsobována tím, že vazby kov-ligand jsou u přechodných kovů první řady méně pevné než u kovů druhé řady, kde jsou méně pevné než u kovů třetí řady. Pokud je na kovovém centru nízká elektronová hustota, pak probíhá redukční eliminace rychleji, než když je elektronová hustota vysoká, protože atom kovu při redukční eliminac elektrony získává.[8]
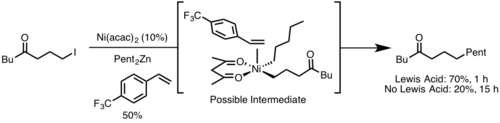
Prostorové uspořádání
Redukční eliminace je obecně rychlejší u kovových center, která jsou více stericky zatěžována, jelikož je sterické zatížení během redukční eliminace zmírněno.[9]
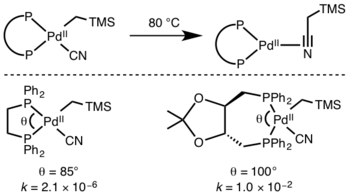
Zúčastněné ligandy
Kinetika redukční eliminace je obtížně předvídatelná, ovšem reakce, které zahrnují hydridy, jsou obzvlášť rychlé díky efektu orbitalového překrytí u přechodného stavu.[10]

Koordinační číslo
Redukční eliminace probíhá u komplexů, kde je koordinační číslo atomu kovu 3 nebo 5 mnohem rychleji, než když má koordinační číslo hodnotu 4 či 6. U komplexů se sudými koordinačními čísly redukční eliminace vede ke vzniku meziproduktu se silným antivazebným orbitalem kov-ligand. Pokud se resukční eliminace provádí u komplexu s lichým koordinačním číslem, pak vzniklý meziprodukt obsadí nevazebný molekulový orbital.[11]

Geometrie komplexů
Redukční eliminace obecně probíhá rychleji u komplexů, jejichž struktura odpovídá struktuře produktu.[2]
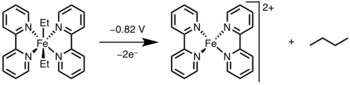
Fotolýza/oxidace
Redukční eliminaci lze urychlit oxidací kovového centra světlem nebo oxidačním činidlem.[12]
Využití
Redukční eliminace má široké využití ve výzkumu i v průmyslu, nejvýznamnější jsou hydrogenace[13], hydroformylace[14] a překřížené párovací reakce.[15] V mnoha těchto katalytických cyklech je redukční eliminace krokem vytvářejícím produkt a také regeneruje katalyzátor, ovšem v Heckově reakci[16] a Wackerově procesu[17] se používá pouze na regeneraci katalyzátoru, jelikož produkty těchto reakcí vznikají beta-hydridovou eliminací.
Reference
V tomto článku byl použit překlad textu z článku Reductive elimination na anglické Wikipedii.
- ↑ a b c CRABTREE, Robert H. The Organometallic Chemistry of the Transition Metals. 6. vyd. [s.l.]: Wiley, 2014. ISBN 978-1-118-13807-6. S. 173. (anglicky)
- ↑ a b c HARTWIG, John F. Organotransition Metal Chemistry, from Bonding to Catalysis. [s.l.]: University Science Books, 2010. ISBN 978-1-891389-53-5. S. 321. (anglicky)
- ↑ GILLIE, A.; STILLE, J. K. Mechanisms of 1,1-Reductive Elimination from Palladium. J. Am. Chem. Soc.. 1980, s. 4933. DOI 10.1021/ja00535a018. (anglicky)
- ↑ OKRASINSKI, S. J.; NORTOM, J. R. Mechanism of Reductive Elimination. 2. Control of Dinuclear vs. Mononuclear Elimination of Methane from cis-Hydridomethyltetracarbonylosmium. J. Am. Chem. Soc.. 1977, s. 295. DOI 10.1021/ja00443a076. (anglicky)
- ↑ MILSTEIN, D. The First Isolated, Stable cis-Hydridoalkylrhodium Complexes and Their reductive Elimination Reaction. J. Am. Chem. Soc.. 1982, s. 5227. DOI 10.1021/ja00383a039. (anglicky)
- ↑ DRIVER, M. S.; HARTWIG, J. F. Carbon−Nitrogen-Bond-Forming Reductive Elimination of Arylamines from Palladium(II) Phosphine Complexes. J. Am. Chem. Soc.. 1997, s. 8232. DOI 10.1021/ja971057x. (anglicky)
- ↑ YAMAMOTO, T.; YAMAMOTO, A.; IKEDA, S. Study of Organo(dipyridyl)nickel Complexes. I. Stability and Activation of the Alkyl-Nickel Bonds of Dialkyl(dipyridyl)nickel by Coordination with Various Substituted Olefins. J. Am. Chem. Soc.. 1971, s. 3350. DOI 10.1021/ja00743a009. (anglicky)
- ↑ GIOVANNINI, R.; STÜDEMANN, T.; DUSSIN, G.; KNOCHEL, P. An Efficient Nickel-Catalyzed Cross-Coupling Between sp3 Carbon Centers. Angew. Chem. Int. Ed.. 1998, s. 2387. DOI 10.1002/(SICI)1521-3773(19980918)37:17<2387::AID-ANIE2387>3.0.CO;2-M. (anglicky)
- ↑ MARCONE, J. E.; MOLOY, K. G. Kinetic Study of Reductive Elimination from the Complexes (Diphosphine)Pd(R)(CN). J. Am. Chem. Soc.. 1998, s. 8527. DOI 10.1021/ja980762i. (anglicky)
- ↑ LOW, J. J.; GODDARD, III, W. A. Reductive Coupling of Hydrogen-Hydrogen, Hydrogen-Carbon, and Carbon-Carbon Bonds from Palladium Complexes. J. Am. Chem. Soc.. 1984, s. 8321. DOI 10.1021/ja00338a067. (anglicky)
- ↑ CRUMPTON-BREGEL, D. M.; GOLDBERG, K. I. Mechanisms of C-C and C-H Alkane Reductive Eliminations from Octahedral Pt(IV): Reaction via Five-Coordinate Intermediates or Direct Elimination?. J. Am. Chem. Soc.. 2003, s. 9442. DOI 10.1021/ja029140u. (anglicky)
- ↑ LAU, W.; HUFFMAN, J. C.; KOCHI, J. K. Electrochemical Oxidation-Reduction of Organometallic Complexes. Effect of the Oxidation State on the Pathways for Reductive Elimination of Dialkyliron Complexes. Organometallics. 1982, s. 155. DOI 10.1021/om00061a027. (anglicky)
- ↑ DE VRIES, J. G. The Handbook of Homogeneous Hydrogenation. [s.l.]: Wiley, 2007. ISBN 978-3-527-31161-3. (anglicky)
- ↑ OJIMA, I.; TSAI, C.-H.; TZAMARIOUDAKI, M.; BONAFOUX, D. The Hydroformylation Reaction. Organic Reactions. 2004, s. 1. DOI 10.1002/0471264180.or056.01. (anglicky)
- ↑ New Trends in Cross-Coupling: Theory and Applications Thomas Colacot (Editor) 2014 ISBN 978-1-84973-896-5
- ↑ DE VRIES, J. G. The Heck reaction in the production of fine chemicals. Can. J. Chem.. 2001, s. 1086. DOI 10.1139/v01-033. (anglicky)
- ↑ DONG, J. J.; BROWNE, W. R.; FERINGA, B. L. Palladium-Catalyzed anti-Markovnikov Oxidation of Terminal Alkenes. Angew. Chem. Int. Ed.. 2015, s. 734. DOI 10.1002/anie.201404856. (anglicky)
Média použitá na této stránce
Autor: Jgurak, Licence: CC BY-SA 4.0
General Reductive Elimination
Autor: Jgurak, Licence: CC BY-SA 4.0
Reductive Elimination Coordination Number
Autor: Jgurak, Licence: CC BY-SA 4.0
Reductive Elimination Participating Ligands
Autor: Jgurak, Licence: CC BY-SA 4.0
Oxidatively-Induced Reductive Elimination
Autor: Jgurak, Licence: CC BY-SA 4.0
Reductive Elimination Bite Angles
Autor: Jgurak, Licence: CC BY-SA 4.0
Octahedral Reductive Elimination
Autor: Jgurak, Licence: CC BY-SA 4.0
Reductive Elimination from Square Planar Complexes
Autor: Jgurak, Licence: CC BY-SA 4.0
Electron-Poor Metal Reductive Elimination
Autor: Jgurak, Licence: CC BY-SA 4.0
Binuclear Reductive Elimination









