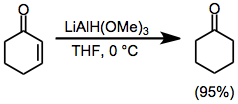
Redukce alkoxyaluminiumhydridy kovů
Redukce alkoxyaluminiumhydridy kovů jsou organické reakce, které spočívají buď v přímé hydrogenaci nenasycených sloučenin, nebo v nahrazení redukovatelné funkční skupiny vodíkem za přítomnosti alkoxyaluminiumhydridového činidla.[1][2]
K redukcím organických sloučenin se často používají tetrahydridoboritan sodný a tetrahydridohlinitan lithný.[3][4] Tato dvě činidla představují mezní případy reaktivity — tetrahydridohlinitan lithný reaguje téměř se všemi redukovatelnými skupinami, zatímco tetrahydridoboritan sodný vstupuje do reakcí s mnohem omezenějším rozsahem skupin. Reaktivitu lze upravit nahrazením jednoho nebo více vodíkových atomů v těchto činidlech alkoxyskupinami.
Pokud je příslušná alkoxyskupina chirální, tak lze příslušnými činidly dosáhnout asymetrických redukcí.[5] Přestože byly postupy využívající stechiometrická množství chirálních hydridů nahrazeny katalytickými, tak mají historický význam jako první příklady stereoselektivních reakcí.
V tabulce níže jsou shrnuty redukce, které mohou být uskutečněny pomocí řady různých aluminiumhydridů a borohydridů. Symbol „+“ naznačuje, že redukce probíhá, „-“, že neprobíhá, „±“, že závisí na struktuře substrátu, a „0“ znamená, že není dostatek dat.
Mechanismus a stereochemie
Převažující mechanismus
Redukce alkoxyaluminiumhydridy většinou probíhají polárním mechanismem.[6] Přenos hydridu na organický substrát vytvoří organický anion, jenž je neutralizován protickým rozpouštědlem nebo kyselinou.
Redukce α,β-nenasycených karbonylových sloučenin mohou mít 1,2-mechanismus (pak jde o přímé adice) nebo 1,4-mechanismus (poté se jedná o konjugované adice). Sklon k 1,4-adicím je v souladu s měkkostí použitých hydridů podle teorie HSAB.[7] Experimentální výsledky potvrzují tyto předpoklady, že „měkčí“ hydridy mají vyšší výtěžky produktů konjugovaných redukcí.[8]
Několik substrátů, jako jsou diarylketony,[9] diarylalkeny,[10] a antraceny,[11] jsou tetrahydridohlinitanem lithným redukovány jednoelektronově.
Alkoxylaluminiumhydridy kovů jsou podrobně prozkoumány jen v několika málo případech.[12] Přesný popis je mnohdy v důsledku disproporcionací na alkoxyalumináty a hydridohlinitany obtížný:[13]
Stereochemie
Vznik diastereoselektivity v redukcích chirálních ketonů bylo podrobně prozkoumáno a modelováno.[14][15] Podle modelu, který vyvinul H. Felkin,[16] diastereoselektivitu řídí relativní energie tří přechodných stavů I, II a III. Přechodný stav I převládá za nepřítomnosti polárních skupin na α uhlíku a stereoselektivita se zvyšuje s velikostí nechirálního ketonového substituentu (R). Přechodný stav III je hlavním u reakcí alkylketonů, kde RM je skupina odtahující elektrony, protože nukleofil a skupina odtahující elektrony mají snahu být co nejdále od sebe.
Byla prozkoumána i diastereoselektivita redukcí cyklických ketonů. Ketony schopné měnit konformace podstupují axiální atak hydridu, který vede k ekvatoriálnímu alkoholu; pevné cyklické ketony ovšem převážně podléhají ekvatoriálním atakům a vytváří axiální alkoholy. Převaha ekvatoriálních ataků u těchto ketonů se vysvětluje tím, že ekvatoriální přiblížení hydridu je méně stericky stíněno než axiální.[17] Převaha axiálních ataků u konformačně volných cyklických ketonů vysvětlili svým modelem H. Felkin a N. T. Anh.[18][19] Přechodný stav u axiálního ataku (IV) je zatížen sterickým odpuzováním mezi axiálními substituenty a přibližujícím se hydridem. Přechodný stav ekvatoriálního ataku (V) se vyznačuje torzním napětím mezi hydridem a ekvatoriálními vodíky. Rozdíl energií těchto napětí určuje převládající směr ataku; u malých R je torzní napětí na V větší, což vede k přednostní tvorbě ekvatoriálního alkoholu.
Možnosti a omezení
Alkoxyaluminiumhydridy a podobná činidla redukují mnoho různých funkčních skupin, přičemž se často dosahuje vysokých selektivit. Například hydrid lithno-tri-terc-butoxy)hlinitý redukuje aldehydy a ketony selektivně za přítomnosti esterů, s nimiž reaguje mnohem pomaleji.[20]
Selektivní redukce α,β-nenasycených ketonů lze provést buď jako 1,2-, nebo jako 1,4-reakce vhodně zvolenými redukčními činidly. Pomocí hydridu lithnotrimethoxyhlinitého, který je stericky nezatížen, je možné uskutečnit téměř kvantitativní přímé adice na karbonylové skupiny,[21] zatímco použití stericky zatíženého hydridu lithnotrimethoxyhlinitého vede k tvorbě produktu konjugované adice.[22]
Štěpení etherů je u většiny hydridových činidel obtížné; pomocí bis(2-methoxyethoxy)hydridohlinitanu sodného (SMEAH) lze však provést debenzylace benzylaryletherů.[23] Tento postup představuje užitečnou náhradu metod založených na použití kyselin nebo hydrogenolýzách (jako jsou reakce s plynným vodíkem katalyzované palladiem na uhlíku).
Epoxidy bývají alkoxyaluminiumhydridy atakovány na méně substituovaných místech. Pokud se v jejich blízkosti nacházejí hydroxylové skupiny, může dojít k vnitromolekulárnímu přesunu hydridu, který umožní selektivní otevření kruhu 1,2-disubstituovaného epoxidu v poloze bližší k hydroxylu.[24] Konfigurace epoxidového uhlíku nezapojeného do reakce se zachovává.
Nenasycené karbonylové sloučeniny mohou být redukovány jak na nenasycené, tak i na nasycené alkoholy. Adicemi bis(2-methoxyethoxy)hydridohlinitanu sodného na nenasycené aldehydy se tvoří nenasycené alkoholy; opačnou adicí vznikne nasycený alkohol.[25]
Některé alkoxyaluminiumhydridy mohou hydroaluminovat alkeny.[26] V podobné reakci vytváří bis(2-methoxyethoxy)hydridohlinitan sodný reakcí se zirkonocendichloridem hydrid zirkonocenchloridu (Schwartzovo činidlo), který je schopen hydrozirkonovat alkeny; ze vzniklých produktů lze reakcemi s elektrofily získat funkcionalizované produkty.[27]
I funkční skupiny obsahující jiné heteroatomy než kyslík lze s využitím alkoxyaluminiumhydridů redukovat na odpovídající uhlovodíky. Primární alkylhalogenidy se za přítomnosti bis(2-methoxyethoxy)hydridohlinitanu sodného redukují na alkany. Sekundární halogenidy reagují pomaleji, ale také vytváří alkany s dobrými výtěžky.[28]
Sulfoxidy mohou být pomocí SMEAH redukovány na příslušné sulfidy.[29]
Iminy jsou alkoxyaluminiumhydridy redukovány na aminy. V níže uvedeném případu se vytváří exo-amin s vysokou diastereoselektivitou. Selektivita redukce hydridem je zde vyšší, než u katalytické hydrogenace.[30]
Podmínky a provedení
Příprava hydridů
Alkoxyaluminiumhydridy se obvykle připravují reakcemi hydridu lithnohlinitého s příslušným alkoholem.[31] Tvorbu alkoxyaluminiumhydridu naznačuje uvolňování vodíku. Stericky zatížené hydridy, jako například hydrid tri-(terc-butoxy)lithnohlinitý, jsou v inertních atmosférách dlouhodobě stálé, ale hydrid trimethoxylithnohlinitý se disproporcionuje a měl by být použit hned po přípravě. Čistý bis(2-methoxyethoxy)hydridohlinitan sodný je v inertní atmosféře stálý několik hodin a lze jej zakoupit jako 70% roztok v toluenu.
Reakční podmínky
Redukce se obvykle provádějí v destilačních baňkách s kulatým dnem, které jsou osazeny zpětným chladičem uzavřeným sušicí trubicí. Reakční směs je míchána mechanickým míchadlem, další hrdla baňky jsou zpravidla osazena přívodem inertní atmosféry (dusíku), teploměrem a přikapávací nálevkou s bočním ramenem na vyrovnávání tlaku. Nejčastěji používanými rozpouštědly jsou tetrahydrofuran a diethylether; jakékoliv rozpouštědlo musí být bezvodé a čisté. Alkoxyaluminiumhydridy mají být co nejsušší a představují nebezpečí požáru, obzvláště při použití nadbytku hydridu (v průběhu reakce se vyvíjí vodík).
Příklad provedení
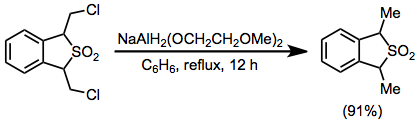
K roztoku 1,3-dihydro-1,3-bis(chlormethyl)benzo[c]-thiofen-2,2-dioxidu (0,584 g, 2,2 mmol) v 50 ml suchého benzenu bylo přidáno 0,80 ml (2,8 mmol) 70% benzenového roztoku NaAlH2(OCH2CH2OCH2)2 a vzniklý roztok byl po 12 hodin refluxován. Směs se ochladila na 0 °C a rozložila 20% kyselinou sírovou. Vrstva benzenu byla oddělena, promyta 10 ml vody, vysušena uhličitanem draselným a zakoncentrována za vzniku produktu v podobě žluté olejovité kapaliny, s 91% (0,480g) výtěžkem.[32]
Reference
V tomto článku byl použit překlad textu z článku Reductions with metal alkoxyaluminium hydrides na anglické Wikipedii.
- ↑ Málek, J. Organic Reactions 1985, 34, 1 DOI:10.1002/0471264180.or034.01
- ↑ Málek, J. 'Organic Reactions 1988, 36, 249 DOI:10.1002/0471264180.or036.03
- ↑ Brown, G. Organic Reactions 1951, 6, 469
- ↑ Schenker, E. in Newer Methods of Preparative Organic Chemistry, Vol. IV., W. Foerst, Ed., Academic Press, New York, 1968, pp. 163–335
- ↑ Itsuno, S. Organic Reactions 1998, 52, 395
- ↑ House, O. Modern Synthetic Reactions, 2nd ed., W. A. Benjamin, Menlo Park, Calif., 1972
- ↑ Pearson, G. Journal of Chemical Education 1968, 45, 581
- ↑ Bottin, J.; Eisenstein, O.; Minot, C.; Anh, T. Tetrahedron Letters, 1972, 3015
- ↑ Cerný, M.; Málek, J. Collect. Czech. Chem. Commun.. 41, 119 (1976).
- ↑ Málek, J.; Cerný, M. Journal of Organometallic Chemistry 1975, 84, 139.
- ↑ Málek, J.; Cerný, M.; Rericha, R. Collect. Czech. Chem. Commun. 1974, 39, 2656.
- ↑ Bec, M.; Huet, J. Bulletin de la Société Chimique de France, 1972, 1636
- ↑ Brown, C.; Shoaf, J. Journal of the American Chemical Society 1964, 86, 1079
- ↑ Cram, J.; Abd Elhafez, A. Journal of the American Chemical Society 1952, 74, 5828
- ↑ Chérest, M.; Prudent, N. Tetrahedron 1980, 36, 1599
- ↑ Chérest, M.; Felkin, H.; Prudent, N. Tetrahedron Letters, 1968, 2199
- ↑ Dauben, W. G.; Fonken, G. J.; Noyce, D. S. Journal of the American Chemical Society 1956, 78, 2579.
- ↑ Chérest, M.; Felkin, H. Tetrahedron Letters, 1971, 383
- ↑ Huet, J.; Maroni-Barnaud, Y.; Anh, N. T.; Seyden-Penne, J. Tetrahedron Letters, 1976, 159
- ↑ Torii, S.; Tanaka, H.; Inokuchi, T.; Tomozane, K. Bulletin of the Chemical Society of Japan 1982, 55, 3947.
- ↑ Danh, N. C.; Arnaud, C.; Huet, J. Bulletin de la Société Chimique de France 1974, 1071
- ↑ Durand, J.; Anh, N. T.; Huet, J. Tetrahedron Letters 1974, 2397
- ↑ Kametani, T.; Huang, S. P.; Ihara, M.; Fukumoto, K. The Journal of Organic Chemistry 1976, 41, 2545
- ↑ Finan, M.; Kishi, Y. Tetrahedron Letters 1982, 23, 2719
- ↑ Bazant, V.; Capka, M.; Cerny, M.; Chvalovský, V.; Kochloefl, K.; Kraus, M.; Málek, J. Tetrahedron Letters, 1968, 3303.
- ↑ Ashby, C.; Noding, A. The Journal of Organic Chemistry 1980, 45, 1035
- ↑ Hart, W.; Schwartz, J. Journal of the American Chemical Society 1974, 96, 8115
- ↑ Capka, M.; Chvalovský, V. Collect. Czech. Chem. Commun. 1969, 34, 3110
- ↑ Weber, L. Chemische Berichte 1983, 116, 2022
- ↑ Law, J.; Lewis, H.; Borne, F. Journal of Heterocyclic Chemistry 1978, 15, 273
- ↑ Véle, I.; Fusek, J.; Štrouf, O. Collect. Czech. Chem. Commun. 1972, 37, 3063
- ↑ Barton, T. J.; Kippenhan, R. C. The Journal of Organic Chemistry 1972, 37, 4194
Média použitá na této stránce
Autor: OrganicReactions, Licence: CC BY 3.0
reduction of unsaturated carbonyl compounds with alkoxyaluminum hydrides
Autor: OrganicReactions, Licence: CC BY 3.0
Reduction with alkyoxyaluminum hydrides (lithium aluminum hydride and derivatives): scope
Autor: OrganicReactions, Licence: CC BY 3.0
Reduction with alkyoxyaluminum hydrides (lithium aluminum hydride and derivatives): scope
Autor: OrganicReactions, Licence: CC BY 3.0
Transition state models for diastereoselective reductions of cyclic ketones.
Autor: OrganicReactions, Licence: CC BY 3.0
Reduction with alkyoxyaluminum hydrides (lithium aluminum hydride and derivatives): scope
Autor: OrganicReactions, Licence: CC BY 3.0
Reduction with alkyoxyaluminum hydrides (lithium aluminum hydride and derivatives): scope
Autor: OrganicReactions, Licence: CC BY 3.0
Reduction with alkyoxyaluminum hydrides (lithium aluminum hydride and derivatives): scope
Autor: OrganicReactions, Licence: CC BY 3.0
alkoxyaluminum hydride reduction (lithium aluminum hydride and others) basic mechanism
Autor: OrganicReactions, Licence: CC BY 3.0
reduction of unsaturated ketones with alkoxyaluminum hydride reagents
Autor: OrganicReactions, Licence: CC BY 3.0
alkoxyaluminum hydride reduction (lithium aluminum hydride and others) mechanism: conjugate addition
Autor: OrganicReactions, Licence: CC BY 3.0
Alkoxy aluminum hydride reduction: example of alkyl chloride reduction to alkane
Autor: OrganicReactions, Licence: CC BY 3.0
selective reduction of a ketone in the presence of an ester
Autor: OrganicReactions, Licence: CC BY 3.0
Reduction with alkyoxyaluminum hydrides (lithium aluminum hydride and derivatives): scope
Autor: OrganicReactions, Licence: CC BY 3.0
Transition states for diastereoselective reductions of chiral ketones and aldehydes.
Autor: OrganicReactions, Licence: CC BY 3.0
Reduction with alkyoxyaluminum hydrides (lithium aluminum hydride and derivatives): scope
Autor: OrganicReactions, Licence: CC BY 3.0
scope of reduction of organic compounds with metal alkoxyaluminum hydrides or borohydrides