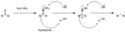Redukce karbonylových sloučenin

Redukce karbonylových sloučenin jsou organické redukční reakce, jejichž substráty jsou karbonylové sloučeniny; může jít o ketony, aldehydy, karboxylové kyseliny, estery a acylhalogenidy. Karboxylové kyseliny, estery a acylhalogenidy lze, v závislosti na síle redukčního činidla, redukovat na aldehydy nebo na primární alkoholy, ketony mohou být podobně převedeny na sekundární alkoholy. Při deoxygenacích je možné alkoholy dále redukovat za odstranění hydroxylových skupin.
Častými redukčními činidly jsou hydridy boru a hliníku; významnou metodou je také katalytická hydrogenace, tedy redukce vodíkem. Před objevem rozpustných zdrojů hydridů byly estery redukovány Bouveaultovou–Blancovou reakcí,[1][2][3] kde se používá kovový sodík za přítomnosti alkoholů.[4][5]
Redukce derivátů karboxylových kyselin, aldehydů a ketonů na alkoholy
Redukce hydridy
Mechanismus
Reakční mechanismus redukce pomocí hydridů kovů spočívá v nukleofilní adici hydridu na karbonylový uhlík. V některých případech se k aktivaci karbonylových skupin používají kationty alkalických kovů, především Li+, které se koordinují na karbonylový kyslík, čímž navyšují elektrofilitu karbonylu.
Při redukcích derivátů karboxylových kyselin po redukci hydridem hliníku dochází k eliminaci meziproduktu, čímž se vytvoří aldehyd (který lze dále zredukovat na alkohol):

Při redukcích aldehydů a ketonů hydrid přemění sloučeninu na alkoxid, který je následně protonován a vytvoří se alkohol:

Reaktivita karbonylů

Ketony jsou obecně méně reaktivní než aldehydy, protože mají výraznější sterické efekty; alkylová skupina navíc dodává elektronovou hustotu na částečný kladný náboj vazby C=O,[6] aldehydy se tak redukují snadněji než ketony, za použití méně agresivních činidel a v mírnějších podmínkách. Karboxylové kyseliny a estery jsou dále stabilizovány druhým atomem kyslíku, který dodává volný elektronový pár vazbě C=O. Acylhalogenidy jsou nejméně stálé karbonyly, protože halogenidy jsou špatnými donory elektronů a dobrými odstupujícími skupinami.[7]
Z výše uvedených důvodů se nejčastěji redukují acylhalogenidy, ketony a aldehydy, jelikož kyseliny a estery vyžadují tvrdší podmínky.
Reaktivita hydridů
Redukční schopnosti hydridů jsou ovlivňovány čtyřmi faktory. V prvním případě schopnost protiiontu aktivovat karbonyl závisí na tom, jak dobře se dokáže navazovat na karbonylový kyslík. Lithium má menší atomy a je elektrofilnější než sodík, takže se navazuje silněji a karbonyl aktivuje lépe.[8]
Kationty kovů s vícenásobným nábojem, jako jsou Mg2+, Zn2+ a Al3+, mají větší hustotu náboje a jsou tak i silnějšími aktivátory než Na+.[9]
Druhým faktorem je vliv centrálního kovu. Atom hliníku je větší než u boru, takže se na hydridy váže slaběji a je náchylnější k atakům; hlinité hydridy jsou tak lepšími reduktanty než borohydridy.[10]
Význam zde mají také sterické efekty, jež mohou výrazně oslabit redukční schopnosti substituovaných hydridů (které mají jednu nebo více hydridových skupin nahrazených organickými substituenty): například triacetoxyborohydrid sodný (NaBH(OAc)3) lze použít na selektivní redukci aldehydů za přítomnosti méně reaktivních ketonů, které se neredukují.[11]
Substituenty mohou ovlivnit reaktivitu redukčního činidla i jiným způsobem: acetoxy skupiny snižují reaktivitu NaBH(OAc)3 nejenom sterickými efekty, ale také odtahováním elektronů. Tuto vlastnost mají rovněž nitrily, zatímco skupiny dodávající elektrony, například alkyly, mohou reaktivitu navyšovat, což se děje například u triethylborohydridu lithného, který je natolik silným nukleofilem, že v průběhu reakce zamezuje nežádoucím přesmykům.
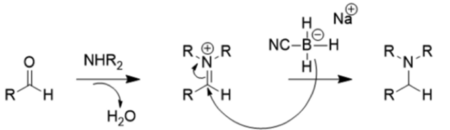
Vzhledem k těmto vlivům je NaBH3CN velmi slabým redukčním činidlem při pH nad 4, takže přednostně probíhají redukční aminace:
Tetrahydridoboritan sodný je poměrně slabým redukčním činidlem a používá se na redukce ketonů a aldehydů, protože na rozdíl od hydridu lithnohlinitého umožňuje přítomnost mnoha různých funkčních skupin, jako jsou nitroskupiny, nitrily a estery, a jako rozpouštědlo může sloužit voda nebo ethanol.[12]
Hydrid lithnohlinitý a jiné silné reduktanty, jako jsou diisobutylaluminiumhydrid, L-selektrid, diboran, diazen a alan, mohou také redukovat aldehydy a ketony, ale často se nepoužívají, protože jsou jejich reakce nebezpečné.[13] Tyto sloučeniny jsou ovšem vhodné na redukce karboxylových kyselin a esterů na alkoholy, kde borohydrid sodný není dostatečně silný.
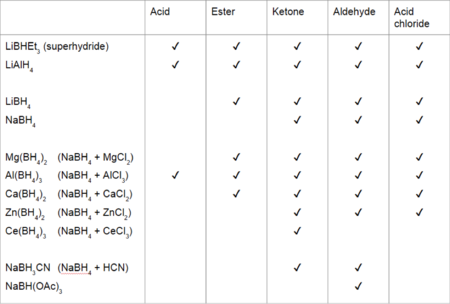
V následující tabulce jsou znázorněny různé karbonylové skupiny a činidla, kterými je lze redukovat (účinnost některých reduktantů závisí na podmínkách reakce):
Redukce derivátů karboxylových kyselin a aldehydů
Redukce hydridy kovů
Příprava aldehydů z derivátů karboxylových kyselin je často obtížná, protože slabší redukční činidla (například borohydrid sodný) nedokáží zredukovat estery a karboxylové kyseliny a silnější (například LiAlH4) redukují vytvořené aldehydy na alkoholy.[14]
Acylchloridy jsou méně stabilní než aldehydy a ketony, takže se často využívají na syntézy aldehydů spolu se stericky zatíženými anhydridovými donory; slabší redukční činidlo reaguje přednostně s acylchloridem a aldehyd zůstává nezměněn; běžným redukčním činidlem pro tento účel je diisobutylaluminiumhydrid (DIBAL-H): i když obvykle redukuje všechny karbonyly, tak se redukce zastaví u aldehydu, pokud se použije pouze jeden ekvivalent a za nízké teploty.[15]
U LiAl(OtBu)3 (připraveného na místě z LiAlH4 a tBuOH) může také být redukce zastavena na aldehydu, a to podobným mechanismem jako u DIBAL-H.[16]
Jiné postupy
Tradiční postup přípravy aldehydů bez jejich redukce na alkoholy - pomocí stericky bráněných hydridů a reaktivních karbonylů - je omezen úzkým rozsahem substrátů a silnou závislostí na podmínkách reakce. Jinou možnost představuje redukce derivátu karboxylové kyseliny na alkohol, který se následně zoxiduje na aldehyd. Také lze použít tvorbu thioesteru nebo Weinrebův amid a následnou redukci produktu Fukujamovou redukcí v prvním a Weinrebovou reakcí v druhém případě, nebo katalytickou hydrogenaci, jako je Rosenmundova redukce.

Při Fukujamově redukci je karboxylová kyselina nejprve přeměněna na thioester reakcí s thiolem (podobnou esterifikaci),[17] thioester se poté redukuje na aldehyd pomocí silylhydridu a palladiového katalyzátoru.
Při Weinrebově syntéze ketonů se acylchlorid nejprve přemení na Weinrebův amid, který poté reaguje s organokovovou sloučeninou za vzniku ketonu, případně s hydridem lithnohlinitým na aldehyd:[18]

Weinrebův amid se redukuje přes stabilní chelát, čímž se liší od reakcí s hydridy, kde se vytváří elektrofilní karbonyly; chelát se tak redukuje jen jednou:

Rosenmundovou redukcí se přeměňují acylchloridy na aldehydy reakcí s plynným vodíkem za katalýzy síranem palladnatým nebo barnatým, jejichž malý povrch zabraňuje přeredukování.[19]
Redukce aldehydů a ketonů na alkany

Aldehydy a ketony lze redukovat i na alkany.K tomuto účelu mohou sloužit například Clemmensenova redukce (v silně kyselém prostředí) a Wolffova–Kižněrova redukce (v silně zásaditém prostředí), a také řada modifikací Wolffovy–Kižněrovy redukce; například Cagliotiova varianta využívá tosylhydrazony s donory za mírnějších podmínek, kde není potřeba zásada;[20] Myersova varianta se vyznačuje nahrazením hydrazinu bis(terc-butyldimethylsilyl)hydrazinem, provedením za pokojové teploty, rychlým průběhem a velkou účinností.[21]
Redukce aromatických karbonylových sloučenin
Aromatické karbonylové sloučeniny se lépe redukují na příslušné deriváty cykloalkanů než na alifatické sloučeniny.[22] Ketony lze za mírných podmínek na odpovídající alkylbenzeny přeměnit pomocí katalytických hydrogenací[23][24] nebo Birchových redukcí.[25]
α,β-nenasycené karbonylové sloučeniny

Při α,β-redukcích (také nazývaných konjugované redukce) jsou substráty α,β-nenasycené karbonylové sloučeniny, enony nebo enaly.
Při redukcích těchto sloučenin probíhají současně dva druhy reakce - 1,2-redukce, kdy se tvoří allylalkoholy, a 1,4-redukce, vytvářející nasycené ketony či aldehydy. Níže zobrazená redukce enonu NaBH4 má dva možné produkty: první vzniká 1,4-redukcí a druhý 1,2-redukcí.[12]

Čím více stericky zatížen je enonový substrát, tím větší podíl bude mít 1,2 redukce.[12] K selektivní tvorbě alkoholu a omezení vzniku 1,4-produktu lze použít Lucheovu redukci, kdy jako zdroj hydridu slouží větší molekula Ce(BH4)3 (získaná reakcí NaBH4 s CeCl3).[26]
Zn(BH4)2 jako zdroj hydridů také vykazuje 1,2 selektivitu, navíc i lepší diastereoselektivitu; koordinuje se nejen na karbonylový kyslík, ale také na sousední atomy:[27]

Stereoselektivita
Diastereoselektivní redukce
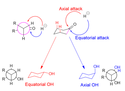
Cyklohexanony mohou být zdroji hydridů atakovány axiálně, kdy vznikají ekvatoriální alkoholy, nebo ekvatoriálně za vzniku axiálních alkoholů. U axiálního ataku (znázorněného červeně) na hydrid působí 1,3-diaxiální napětí. V případě ekvatoriálního ataku (znázorněného modře) hydrid tyto interakce nepůsobí, ale uplatňuje se nevýhodné torzní napětí pokud se vznikající alkohol s navazovaným vodíkem v meziproduktu překrývají (což ukazuje Newmanova projekce axiálního alkoholu).

Redukční činidla s velkými molekulami, například LiBH(Me2CHCHMe)3, jsou stíněné 1,3-axiálními interakcemi a vážou se tak ekvatoriálně.[12] Malá redukční činidla, jako je NaBH4, přednostně atakují axiálně, čímž se vyhýbají zákrytovým interakcím, protože 1,3-diaxiální interakce jsou u nich slabé; tuto převahu vyvolávají částečně také sterické důvody.[28]
Posílením sterických efektů (a také 1,3-axiálních interakcí) se ovšem sníží vliv axiálních ataků, a to i u malých hydridových donorů.[29]
Enantioselektivní redukce
Při redukcích chirálních ketonů se vytvářejí chirální sekundární alkoholy; vznik určitých enantiomerů lze řídit chirálními katalyzátory.
Často používanými enantioselektivními redukcemi karbonylových sloučenin jsou Nojoriova asymetrická hydrogenace (redukce beta-ketoesterů pomocí Ru/BINAP) a Coreyova–Itsunova redukce (BH3, chirální katalyzátor odvozený od prolinu).
Reference
V tomto článku byl použit překlad textu z článku Carbonyl reduction na anglické Wikipedii.
- ↑ Louis Bouveault; Gustave Louis Blanc. Préparation des alcools primaires au moyen des acides correspondants. Comptes rendus de l'Académie des Sciences. 1903, s. 1676–1678. Dostupné online.
- ↑ Louis Bouveault; Gustave Louis Blanc. Préparation des alcools primaires au moyen des acides correspondants. Comptes rendus de l'Académie des Sciences. 1903, s. 60–62.
- ↑ Louis Bouveault; Gustave Louis Blanc. Transformation des acides monobasiques saturés dans les alcools primaires correspondants. Bulletin de la Société Chimique de France. 1904, s. 666–672. Dostupné online.
- ↑ MOFFETT, Robert Bruce. 2-(1-Pyrrolidyl)propanol. Org. Synth.. 1953, s. 82. Dostupné online. doi:10.15227/orgsyn.033.0082.; Coll. Vol.. S. 834.
- ↑ MCMURRY, John E. Isoxazole Annelation Reaction: 1-Methyl-4,4a,5,6,7,8-hexahydronaphthalen-2(3H)-one. Org. Synth.. 1973, s. 70. Dostupné online. doi:10.15227/orgsyn.053.0070.; Coll. Vol.. S. 781.
- ↑ Alex Roche. Ketones and Aldehydes [online]. Rutgers University [cit. 2015-12-01]. Dostupné online.
- ↑ Jonathan Clayden. Organic Chemistry. [s.l.]: OUP Oxford, 2012. Dostupné online. ISBN 978-0199270293. S. 200.
- ↑ Burkhard König. Reduction Reactions [online]. Institut für Organische Chemie, Uni Regensburg, 2009 [cit. 2015-12-01]. Dostupné v archivu pořízeném dne 2015-08-24.
- ↑ Liam Cox. Nucleophilic Addition Reactions of Aldehydes and Ketones [online]. University of Birmingham, 2007 [cit. 2015-12-01]. Dostupné online.
- ↑ Linda M. Sweeting. Reducing Agents [online]. Towson University, 2001 [cit. 2015-12-01]. Dostupné v archivu pořízeném z originálu dne 2015-11-16.
- ↑ Gordon W. Gribble; Duncan C. Ferguson. Reactions of sodium borohydride in acidic media. Selective reduction of aldehydes with sodium triacetoxyborohydride. Journal of the Chemical Society, Chemical Communications. 1975, s. 535–536. doi:10.1039/C39750000535.
- ↑ a b c d Luca Banfi; Enrica Narisano; Renata Riva. Sodium Borohydride. [s.l.]: John Wiley & Sons, 2001-01-01. ISBN 9780470842898. doi:10.1002/047084289x.rs052.
- ↑ Saul W. Chaikin; Weldon G. Brown. Reduction of Aldehydes, Ketones and Acid Chlorides by Sodium Borohydride. Journal of the American Chemical Society. 1949-01-01, s. 122–125. ISSN 0002-7863. doi:10.1021/ja01169a033.
- ↑ Norman G. Gaylord. Reduction with complex metal hydrides. Journal of Chemical Education. 1957-08-01, s. 367. doi:10.1021/ed034p367. Bibcode 1957JChEd..34..367G.
- ↑ L. I. Zakharkin; I. M. Khorlina. Reduction of esters of carboxylic acids into aldehydes with diisobutylaluminium hydride. Tetrahedron Letters. 1962, s. 619–620. doi:10.1016/s0040-4039(00)70918-x.
- ↑ Sergio Cortes. Using Hydrogen as a Nucleophile in Hydride Reductions [online]. University of Texas at Dallas, 2010 [cit. 2015-12-01]. Dostupné online.
- ↑ Tohru Fukuyama; Shao Cheng Lin; Leping Li. Facile reduction of ethyl thiol esters to aldehydes: application to a total synthesis of (+)-neothramycin A methyl ether. Journal of the American Chemical Society. 1990-09-01, s. 7050–7051. ISSN 0002-7863. doi:10.1021/ja00175a043.
- ↑ Steven Nahm; Steven M. Weinreb. N-methoxy-n-methylamides as effective acylating agents. Tetrahedron Letters. 1981, s. 3815–3818. ISSN 0002-7863. doi:10.1016/s0040-4039(01)91316-4.
- ↑ Erich Mosettig; Ralph Mozingo. The Rosenmund Reduction of Acid Chlorides to Aldehydes. [s.l.]: [s.n.], 2004-01-01. ISBN 9780471264187. doi:10.1002/0471264180.or004.07. S. 3815–3818.
- ↑ L. Caglioti; M. Magi. The reaction of tosylhydrazones with lithium aluminium hydride. Tetrahedron. 1963-01-01, s. 1127–1131. doi:10.1016/S0040-4020(01)98571-0.
- ↑ Michael E. Furrow; Andrew G. Myers. Practical Procedures for the Preparation of N-tert-Butyldimethylsilylhydrazones and Their Use in Modified Wolff−Kishner Reductions and in the Synthesis of Vinyl Halides and gem-Dihalides. Journal of the American Chemical Society. 2004-05-01, s. 5436–5445. ISSN 0002-7863. doi:10.1021/ja049694s. PMID 15113215.
- ↑ Shigeo Nishimura. Handbook of Heterogeneous Catalytic Hydrogenation for Organic Synthesis. [s.l.]: Wiley-Interscience, 2001. Dostupné online. ISBN 9780471396987. S. 583.
- ↑ Federica Zaccheria; Nicoletta Ravasio; Mauro Ercoli; Pietro Allegrini. Heterogeneous Cu-catalysts for the reductive deoxygenation of aromatic ketones without additives. Tetrahedron Letters. 2005, s. 7743–7745. doi:10.1016/j.tetlet.2005.09.041.
- ↑ Gordon Walker. Reduction of Enols. New Synthesis of Certain Methoxybenzsuberenes via Hydrogenation of Dehydroacetic Acids. Journal of the American Chemical Society. 1956, s. 3201–3205. doi:10.1021/ja01594a062.
- ↑ Stan Hall; Sharon Lipsky; Frank McEnroe; Anne Bartels. Lithium-ammonia reduction of aromatic ketones to aromatic hydrocarbons. The Journal of Organic Chemistry. 1971, s. 2588–2591. doi:10.1021/jo00817a004.
- ↑ Strategic Applications of Named Reactions in Organic Synthesis, Laszlo Kurti, Barbara Czako ISBN 0-12-429785-4
- ↑ Nick Greeves. Diastereoselective Ketone Reduction [online]. University of Liverpool, 2015 [cit. 2015-12-01]. Dostupné online.
- ↑ Stephen S. Wong; Michael N. Paddon-Row. Theoretical evidence in support of the Anh?Eisenstein electronic model in controlling ?-facial stereoselectivity in nucleophilic additions to carbonyl compounds. Journal of the Chemical Society, Chemical Communications. 1990, s. 456–458. doi:10.1039/c39900000456.
- ↑ S. Krishnamurthy; Herbert C. Brown. Lithium trisiamylborohydride. A new sterically hindered reagent for the reduction of cyclic ketones with exceptional stereoselectivity. Journal of the American Chemical Society. 1976-05-01, s. 3383–3384. ISSN 0002-7863. doi:10.1021/ja00427a061.
Média použitá na této stránce
Autor: Astorbaxter, Licence: CC BY-SA 4.0
Competition of 1,4- vs 1,2-reductions
Autor: Astorbaxter, Licence: CC BY-SA 4.0
Mechanism of Wolff-Kishner reduction
Autor: Astorbaxter, Licence: CC BY-SA 4.0
Table of possible reactions between carbonyl groups and reducing agents
Autor: Astorbaxter, Licence: CC BY-SA 4.0
Overall reaction scheme of Weinreb reaction
Autor: Astorbaxter, Licence: CC BY-SA 4.0
Conversion to thiol followed by Fukuyama reduction