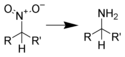
Redukce nitrosloučenin
Redukce nitrosloučenin jsou organické redukční reakce, jejichž substráty jsou nitrosloučeniny. Spektrum reaktantů použitelných k takovým redukcím je široké.
Redukce alkyl- a arylnitrosloučenin probíhají odlišně. Častěji se využívají redukce arylnitrosloučenin.
Aromatické nitrosloučeniny
Redukce na aniliny
Redukce nitroarenů mají průmyslový význam.[1] Je známo více postupů:
- Katalytická hydrogenace za katalýzy: Raneyovým niklem[2], palladiem na uhlíku,[3][4][5] oxidem platiničitým či Urušibarovým niklem.[6]
- Železo v kyselém prostředí.[7][8][9]
- Dithioničitan sodný[10]
- Sulfid sodný (nebo sulfan a zásada). Příkladem může být selektivní redukce dinitrofenolu na nitroaminofenol.[11]
- Chlorid cínatý[12]
- Chlorid titanitý
- Sloučeniny samaria[13]
- Kyselina jodovodíková[14]
Hydridy kovů se obvykle na redukce arylnitrosloučenin nepoužívají, protože vytvářejí azosloučeniny.
Redukce na hydroxylaminy
Bylo popsáno několik způsobů přípravy arylhydroxylaminů z arylnitrosloučenin:
- Raneyův nikl a hydrazin při 0-10 °C[15]
- Elektrolytická redukce[16]
- Kovový zinek ve vodném roztoku chloridu amonného[17]
- Rhodium na uhlíku za přítomnosti nadbytku hydrazinmonohydrátu při pokojové teplotě[18]
Redukce na hydrazinosloučeniny
Reakcemi nitroarenů s přebytkem zinku vznikají N,N'-diarylhydraziny.[19]
Redukce na azosloučeniny
Reakcemi aromatických nitrosloučenin s hydridy kovů se vytvářejí azosloučeniny. Použitelnými reaktanty jsou například:
- Kovový zinek s hydroxidem sodným.[19] (nadbytek zinku redukuje azosloučeninu na hydrazinovou)
Alifatické nitrosloučeniny
Redukce na uhlovodíky
Hydrodenitrace (nahrazení nitroskupin vodíkem) jsou obtížné, ale lze jich dosáhnout katalytickými hydrogenacemi za přítomnosti platiny na silikagelu za vysokých teplot.[21]
Další možností je radikálová reakce tributylcínu a radikálového iniciátoru, jako je azobisizobutyronitril.[22]
Redukce na aminy
Alifatické nitrosloučeniny mohou být redukovány na odpovídající aminy, a to několika způsoby, těmi jsou:
- Katalytická hydrogenace za katalýzy oxidem platiničitým (PtO2)[23] nebo Raneyovým niklem[24]
- Železo v kyselině octové[25]
- Jodid samarnatý[26]
- Raneyův nikl, platina na uhlíku nebo práškový zinek v kyselině mravenčí nebo mravenčanu amonném[6]
α,β-nenasycené nitrosloučeniny lze na nasycené aminy zredukovat těmito způsoby:
- Katalytickou hydrogenací za přítomnosti palladia na uhlíku
- Kovovým železem
- Hydridem lithnohlinitým[27]
- Borohydridem lithným nebo sodným a trimethylsilylchloridem[28]
- Bis(2-methoxyethoxy)hydridohlinitanem sodným[29]
Redukce na hydroxylaminy
Alifatické nitrosloučeniny lze redukovat na alifatické hydroxylaminy, a to diboranem.[30]
Tuto reakci je možné uskutečnit i s práškovým zinkem a chloridem amonným:[31][32][33]
- R-NO2 + 4 NH4Cl + 2 Zn → R-NH-OH + 2 ZnCl2 + 4 NH3 + H2O
Redukce na oximy
Redukce nitrosloučenin na oximy se provádí za přítomnosti solí kovů, jako jsou například chlorid cínatý[34] a chlorid chromnatý.[35]
Oximy lze také získat katalytickou hydrogenací.[36]
Reference
V tomto článku byl použit překlad textu z článku Reduction of nitro compounds na anglické Wikipedii.
- ↑ BOOTH, Gerald. Nitro Compounds, Aromatic. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a17_411. S. a17_411. (anglicky)
- ↑ ALLEN, C. F. H.; VANALLAN, J. 2-Amino-p-cymene. Org. Synth.. 1955. Dostupné online.; Coll. Vol.. S. 63.
- ↑ BAVIN, P. M. G. 2-Aminofluorene. Org. Synth.. 1973. Dostupné online.; Coll. Vol.. S. 30.
- ↑ Michael B. Smith; Jerry March. March's Advanced Organic Chemistry. [s.l.]: John Wiley & Sons, 2007. Dostupné online. ISBN 978-0-471-72091-1. S. 1816.
- ↑ Ram Siya; Richard E. Ehrenkaufer. A general procedure for mild and rapid reduction of aliphatic and aromatic nitro compounds using ammonium formate as a catalytic hydrogen transfer agent. Tetrahedron Letters. 1984, s. 3415–3418. doi:10.1016/S0040-4039(01)91034-2.
- ↑ a b J. P. Adams. Nitro and related groups. Journal of the Chemical Society, Perkin Transactions 1. 2002, s. 2586–2597. doi:10.1039/b009711.
- ↑ FOX, B. A.; THRELFALL, T. L. 2,3-Diaminopyridine. Org. Synth.. 1964, s. 34. doi:10.15227/orgsyn.044.0034.
- ↑ S. A. Mahood; P. V. L. Schaffner. 2,4-Diaminotoluene. Organic Syntheses. 1931, s. 32. doi:10.15227/orgsyn.011.0032.
- ↑ O-Aminobenzaldehyde, Redox-Neutral Aminal Formation and Synthesis of Deoxyvasicinone. Organic Syntheses. 2012, s. 274. doi:10.15227/orgsyn.089.0274.
- ↑ REDEMANN, C. T.; REDEMANN, C. E. 5-Amino-2,3-dihydro-1,4-phthalazinedione. Org. Synth.. 1955. Dostupné online.; Coll. Vol.. S. 69.
- ↑ HARTMAN, W. W.; SILLOWAY, H. L. 2-Amino-4-nitrophenol. Org. Synth.. 1945, s. 5. doi:10.15227/orgsyn.025.0005.
- ↑ Margaret M. Faul; Oliver R. Thiel. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2005. ISBN 9780470842898. doi:10.1002/047084289X.rt112.pub2. Kapitola Tin(II) Chloride.
- ↑ M. K. Basu. Ultrasound-promoted highly efficient reduction of aromatic nitro compounds to the aromatic amines by samarium/ammonium chloride. Tetrahedron Letters. 2000, s. 5603–5606. doi:10.1016/S0040-4039(00)00917-5.
- ↑ J. S. Dileep Kumar; ManKit M. Ho; Tatsushi Toyokuni. Simple and chemoselective reduction of aromatic nitro compounds to aromatic amines: reduction with hydriodic acid revisited. Tetrahedron Letters. 2001, s. 5601–5603. doi:10.1016/s0040-4039(01)01083-8.
- ↑ N. R. Ayyangar; K. C. Brahme; U. R. Kalkote; K. V. Srinivasan. Facile Transfer-Reduction of Nitroarenes to N Arylhydroxylamines with Hydrazine in the Presence of Raney Nickel. Synthesis. 1984, s. 938. doi:10.1055/s-1984-31027.
- ↑ HARMAN, R. E. Chloro-p-benzoquinone. Org. Synth.. 1963. Dostupné online.; Coll. Vol.. S. 148.
- ↑ KAMM, O. β-Phenylhydroxylamine. Org. Synth.. 1941. Dostupné online.; Coll. Vol.. S. 445.
- ↑ S. Ichikawa; S. Zhu; S. Buchwald. A Modified System for the Synthesis of Enantioenriched N-Arylamines through Copper-Catalyzed Hydroamination. Angewandte Chemie International Edition. 2018, s. 8714–8718. doi:10.1002/anie.201803026. PMID 29847002.
- ↑ a b BIGELOW, H. E.; ROBINSON, D. B. Azobenzene. Org. Synth.. 1955. Dostupné online.; Coll. Vol.. S. 103.
- ↑ R. F. Nystrom; W. G. Brown. Reduction of Organic Compounds by Lithium Aluminum Hydride. III. Halides, Quinones, Miscellaneous Nitrogen Compounds. Journal of the American Chemical Society. 1948, s. 3738–3740. doi:10.1021/ja01191a057. PMID 18102934.
- ↑ M. J. Guttieri; W. F. Maier. Selective cleavage of carbon-nitrogen bonds with platinum. The Journal of Organic Chemistry. 1984, s. 2875–2880. doi:10.1021/jo00190a006.
- ↑ T. V. (Babu) RajanBabu, Philip C. Bulman Page, Benjamin R. Buckley, "Tri-n-butylstannane" Encyclopedia of Reagents for Organic Synthesis 2004, John Wiley & Sons. doi:10.1002/047084289X.rt181.pub2
- ↑ A. T. Nielsen. The Isomeric Dinitrocyclohexanes. II. Stereochemistry. The Journal of Organic Chemistry. 1962, s. 1998–2001. doi:10.1021/jo01053a019.
- ↑ DAUBEN, JR., H. J.; RINGOLD, H. J.; WADE, R. H.; PEARSON, D. L.; ANDERSON, JR., A. G. Cycloheptanone. Org. Synth.. 1963. Dostupné online.; Coll. Vol.. S. 221.
- ↑ M. Senkus. The Isomeric Dinitrocyclohexanes. II. Stereochemistry. Industrial & Engineering Chemistry Research. 1948, s. 506.
- ↑ A. S. Kende; J. S. Mendoza. Controlled reduction of nitroalkanes to alkyl hydroxylamines or amines by samarium diiodide. Tetrahedron Letters. 1991, s. 1699–1702. doi:10.1016/S0040-4039(00)74307-3.
- ↑ A. Burger; M. L. Stein; J. B. Clements. Some Pyridylnitroalkenes, Nitroalkanols, and Alkylamines. The Journal of Organic Chemistry. 1957, s. 143–144. doi:10.1021/jo01353a010.
- ↑ A. Giannis; K. Sandhoff. LiBH4(NaBH4)/Me3SiCl, an Unusually Strong and Versatile Reducing Agent. Angewandte Chemie International Edition in English. 1989, s. 218–220. doi:10.1002/anie.198902181.
- ↑ John R. Butterick; A. M. Unrau. Reduction of β-nitrostyrene with sodium bis-(2-methoxyethoxy)-aluminium dihydride. A convenient route to substituted phenylisopropylamines. Journal of the Chemical Society, Chemical Communications. 1974, s. 307–308. doi:10.1039/c39740000307.
- ↑ H. Feuer; R. S. Bartlett; B. F. Vincent; R. S. Anderson. Diborane Reduction of Nitro Salts. A New Synthesis of N-Monosubstituted Hydroxylamines. The Journal of Organic Chemistry. 1965, s. 2880–2882. doi:10.1021/jo01020a002.
- ↑ P. W. G. Smith; A. R. Tatchell. Fundamental Aliphatic Chemistry Aliphatic Nitro Compounds and Amines. [s.l.]: Elsevier, 1965. Dostupné online. ISBN 978-0-08-010746-2. doi:10.1016/b978-0-08-010746-2.50016-8. S. 2880–2882.
- ↑ Sean M. Kelly; Bruce H. Lipshutz. Chemoselective Reductions of Nitroaromatics in Water at Room Temperature. Organic Letters. 2014-01-03, s. 98–101. ISSN 1523-7060. doi:10.1021/ol403079x. PMID 24341483.
- ↑ Stéphane Ung; Annie Falguières; Alain Guy; Clotilde Ferroud. Ultrasonically activated reduction of substituted nitrobenzenes to corresponding N-arylhydroxylamines. Tetrahedron Letters. 2005, s. 5913–5917. Dostupné online. doi:10.1016/j.tetlet.2005.06.126.
- ↑ V. J. Braun; W. Sobecki. Über primäre Dinitro-, Nitronitrit- und Dialdoxim-Verbindungen der Fettreihe. Chemische Berichte. 1911, s. 2526–2534. Dostupné online. doi:10.1002/cber.19110440377.
- ↑ J. R. Hanson; E. Premuzic. Applications of chromous chloride--II : The reduction of some steroidal nitro-compounds. Tetrahedron. 1967, s. 4105–4110. doi:10.1016/S0040-4020(01)97921-9.
- ↑ C. Grundmann. Über die partielle Reduktion von Nitro-cyclohexan. Angewandte Chemie. 1950, s. 558–560. doi:10.1002/ange.19500622304.
Média použitá na této stránce
Generalized reaction scheme used in the article: Reduction of nitro compounds.
Chemical diagram showing a generic reduction of nitrobenzene to give aniline
Generalized reaction scheme used in the article: Reduction of nitro compounds.