Reduktivní aminace
Reduktivní aminace je organická reakce, druh aminace, při které dochází k přeměně karbonylové skupiny ketonu nebo aldehydu na aminovou přes iminový meziprodukt. Jedná se o nejvýznamnější způsob výroby aminů, získává se takto například většina aminů používaných na výrobu léčiv.[1][2]
Průběh reakce
Reduktivní aminace začíná reakcí aminu s karbonylovou skupinou za tvorby poloaminalu, který následně odštěpí jednu molekulu vody zvratnou alkylimino-de-oxo-bisubstitucí, čímž vznikne imin. Rovnováhu mezi karbonylovou sloučeninou a iminem lze posunout ve prospěch iminu odstraňováním vznikající vody fyzikálními nebo chemickými postupy. Imin může být izolován a následně vhodným redukčním činidlem, například tetrahydridoboritanem sodným, redukován na amin. Tento postup se označuje jako nepřímá reduktivní aminace.
Tvorba iminu a jeho redukce mohou také probíhat ve stejné nádobě; tento postup se nazývá přímá reduktivní aminace. Používají se při něm redukční činidla, která snadněji reagují s protonovanými iminy než s aldehydy či ketony. Také musí být použitelné v mírně kyselém prostředí. Nejčastěji se používají kyanohydridoboritan sodný (NaBH3CN) a triacetoxyhydridoboritan sodný (NaBH(OCOCH3)3).[3] Reakci lze provést ve vodném roztoku, což vyvolává pochyby o nutnosti tvorby iminu.[4][5] Předpokládá se, že i tato varianta reduktivní aminace probíhá přes poloaminalové meziprodukty.[6]
Obměny reduktivní aminace a podobné reakce
Reduktivní aminaci se podobá Eschweilerova–Clarkeova reakce, při které dochází k methylaci aminů za vzniku terciárních aminů a Leuckartova–Wallachova reakce.[7] Podobné reduktivní aminaci jsou také Mannichova reakce a Petasisova reakce.
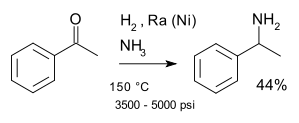
Dalším příkladem je Mignonacova reakce, popsaná roku 1921,[8] při které reagují ketony s amoniakem za přítomnosti katalyzátoru obsahujícího nikl; příkladem je příprava 1-fenylethylaminu z acetofenonu:[9]
V současnosti se reduktivní aminace provádějí pomocí kyselino-kovových katalyzátorů, které zprostředkovávají přenos hydridových skupin. Při většině studií zaměřených na tyto reakce se ukázala jejich vysoká výtěžnost.[10]
Průmyslová výroba terciárních aminů, jako jsou triethylamin a diisopropylethylamin, se provádí přímou reakcí ketonů se směsí amoniaku a vodíku za přítomnosti vhodného katalyzátoru.
Biochemie
Při biosyntéze řady α-aminokyselin dochází k reduktivní aminaci α-ketokyseliny, obvykle pomocí enzymu patřícího mezi transaminázy. Katalyzátorem bývá pyridoxaminfosfát, který se po skončení redakce přeměňuje na pyridoxalfosfát. V prvním kroku zde dochází k tvorbě iminu, ovšem hydridy jsou nahrazeny redukovaným pyridinem a vzniká aldimin, který se hydrolyzuje na amin.[11] Souhrnná rovnice vypadá takto:
- HO2CC(O)R → HO2CC(=NCH2–X)R → HO2CCH(N=CH–X)R → HO2CCH(NH2)R.
Odkazy
Související články
- Leuckartova reakce
Reference
V tomto článku byl použit překlad textu z článku Reductive amination na anglické Wikipedii.
- ↑ Stuart Warren; Paul Wyatt. Organic Synthesis : the disconnection approach. Oxford: Wiley-Blackwell, 2008. Dostupné online. ISBN 978-0-470-71236-8. S. 54.
- ↑ Oleg I. Afanasyev; Ekaterina Kuchuk; Dmitry L. Usanov; Denis Chusov. Reductive Amination in the Synthesis of Pharmaceuticals. Chemical Reviews. 2019-10-21. DOI 10.1021/acs.chemrev.9b00383.
- ↑ Ellen W. Baxter; Allen B. Reitz. Organic Reactions. Příprava vydání Larry E. Overman. [s.l.]: [s.n.], 2004. Dostupné online. ISBN 978-0-471-17655-8. DOI 10.1002/0471264180.or059.01. Kapitola Reductive Aminations of Carbonyl Compounds with Borohydride and Borane Reducing Agents, s. 1-714.
- ↑ Shinya Sato; Takeshi Sakamoto; Etsuko Miyazawa; Yasuo Kikugawa. One-pot reductive amination of aldehydes and ketones with α-picoline-borane in methanol, in water, and in neat conditions. Tetrahedron. 2004, s. 7899–7906. DOI 10.1016/j.tet.2004.06.045.
- ↑ Colin J. Dunsmore; Reuben Carr; Toni Fleming; Nicholas J. Turner. A Chemo-Enzymatic Route to Enantiomerically Pure Cyclic Tertiary Amines. Journal of the American Chemical Society. 2006, s. 2224–2225. DOI 10.1021/ja058536d. PMID 16478171.
- ↑ Vladimir A. Tarasevich; Nikolai G. Kozlov. Reductive amination of oxygen-containing organic compounds. Russian Chemical Reviews. 1999, s. 55–72. DOI 10.1070/RC1999v068n01ABEH000389. Bibcode 1999RuCRv..68...55T.
- ↑ Frederick George; Bernard Saunders. Practical Organic Chemistry, 4th Ed.. London: Longman, 1960. Dostupné online. ISBN 9780582444072. S. 223.
- ↑ Georges Mignonac. Nouvelle méthode générale de préparation des amines à partir des aldéhydes ou des cétones. Comptes rendus. 1921, s. 223. Dostupné online.
- ↑ ROBINSON, John C.; SNYDER, H. R. α-Phenylethylamine. Org. Synth.. 1955. Dostupné online. DOI 10.1002/0471264180.os023.27. (anglicky); Coll. Vol.. S. 717. (anglicky)
- ↑ Roozbeh Javad Kalbasi; Omid Mazaheri. Synthesis and characterization of hierarchical ZSM-5 zeolite containing Ni nanoparticles for one-pot reductive amination of aldehydes with nitroarenes. Catalysis Communications. 2015, s. 86–91. DOI 10.1016/j.catcom.2015.05.016.
- ↑ Nelson, D. L.; Cox, M. M. "Lehninger, Principles of Biochemistry" 3rd Ed. Worth Publishing: New York, 2000. ISBN 1-57259-153-6.
Média použitá na této stránce
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Reductive_amination_acetophenone_ammonia John C. Robinson, Jr. and H. R. Snyder (1955). "αPhenylethylamine". Org. Synth.; Coll. Vol. 3: 717.