Rodopsin
Rodopsin, též rhodopsin, někdy zrakový purpur, oční purpur (z řeckého rhodon „růže“, opsis „zrak“; -in značí sloučeninu) je zrakový pigment citlivý na světlo a nacházející se v tyčinkách sítnice komorového oka obratlovců, hlavonožců a některých členovců. Je to transmembránový protein ze skupiny receptorů spřažených s G-proteinem, obsahující nebílkovinnou složku retinal. Je schopný na základě přicházejícího světla vyvolat v buňce biochemickou dráhu, která směřuje ke vzniku nervových impulsů. Představuje tak základní molekulární princip vidění.
Funkce
Rodopsin je transmembránový protein složený z proteinové složky opsinu a karotenové složky retinalu. Retinal je schopný cis-trans izomerie. Cis konfigurace retinalu je pevně vázána na lysinový zbytek opsinového proteinu a představuje klidový stav. Retinal je však schopen prudce reagovat na dopadající fotony světla. Když totiž dojde k absorpci světla cis-retinalem, změní se na all-trans izomer a uvolní se do cytoplazmy. Změnou konformace rodopsinu se aktivuje G-protein transducin. Ten aktivuje cGMP fosfodiesterázu, která rozkládá cGMP na otevřený GMP. Když však v tyčinkách není cGMP, dojde k uzavření sodíkových iontových kanálů, a tak dochází k hyperpolarizaci membrány. To inhibuje synapse na tyčinkových buňkách a vede to k zastavení produkce jistých neurotransmiterů. Jejich nedostatek způsobí depolarizaci membrány nervových buněk v sítnici a vznik akčního potenciálu v očním nervu. Následně dojde k dodání této informace do mozku.[1][2]
Poté (bez přidávání energie fotonem) probíhá zpětná reakce vzniku rodopsinu: all-trans retinal se mění za pomoci retinal izomerázy na 11-cis retinal, který se váže se skotopsinem a vzniká opět rodopsin. Zpětná syntéza na rodopsin je zapříčiněna nedostatkem světla (přechod ze světla do tmy).
Vitamín A
Zpětná přeměna all-trans retinalu na 11-cis retinal probíhá lépe za přítomnosti vitamínu A1 (retinol). Vitamín A1 se také syntetizuje z retinalu (= aldehyd vitamínu A1), který vzniká při rozpadu rodopsinu. Při nedostatku vitamínu A1 se špatně zpětně produkuje rodopsin, což se může projevit šeroslepostí (hemeralopie). Z toho vyplývá, že staré moudro našich babiček „Jez mrkvičku, abys dobře viděl,“ má pravdivý základ[3][4].
Výskyt
Rodopsin se vyskytuje v tyčinkových buňkách všech obratlovců a některých bezobratlých (hlavonožců a některých členovců).
U člověka je obsažen v membráně disků, kterých je v tyčince až 2000; v tyčince je asi 100 milionů molekul rodopsinu. Rodopsin absorbuje světlo v celé oblasti viditelného světla s maximem okolo 505 nm.[5]
Kanálové rodopsiny vyskytující se u zelených řas se liší svým účelem – fungují jako světlem řízené transmembránové kationtové kanály regulující např. vnitrobuněčnou kyselost.
Příbuzné látky se vyskytují i u prokaryot, často s odlišnou funkcí: bakteriorodopsin, proteorodopsin a xanthorodopsin jsou transmembránovými protonovými pumpami zajišťujícími fototrofii, halorodopsin je světlem aktivovanou transmembránovou chloridovou pumpou (u archeí skupiny Halobacteria),[1] senzorické rodopsiny řídí fototaxi (pohyb směrem od zdroje nebo ke zdroji světla) a jejich funkce je tak nejbližší funkci rodopsinu živočichů, xenorodopsin slouží pravděpodobně jako ochranný pigment.[6]
Objevitel rodopsinu
Rodopsin objevil a popsal německý anatom Heinrich Müller v roce 1851.[7][8]
Odkazy
Reference
- ↑ a b SMITH, C. U. M. Elements of Molecular Neurobiology. 3. vyd. Chichester: John Wiley & Sons, 2002. ISBN 0-470-84353-5.
- ↑ MURRAY, Robert K., Daryl K. Granner, Peter A. Mayes, Victor W. Rodwell. Harper's Illustrated Biochemistry. [s.l.]: Lange Medical Books/McGraw-Hill; Medical Publishing Division, 2003. ISBN 0-07-138901-6.
- ↑ Rhodopsin. In: Hemeralopie. In: Velký lékařský slovník. ©1998–2017 [cit. 23. 9. 2017]. Dostupné z: http://lekarske.slovniky.cz/pojem/hemeralopie
- ↑ Rhodopsin. In: KROUPOVÁ, Kateřina a kol. Slovník speciálněpedagogické terminologie: vybrané pojmy. Praha: Grada, 2016, s. 80–81. Edice Pedagogika. ISBN 978-80-247-5264-8.
- ↑ Rhodopsin. In: Velký lékařský slovník. ©1998–2017 [cit. 23. 9. 2017]. Dostupné z: http://lekarske.slovniky.cz/pojem/rhodopsin
- ↑ UGALDE, Juan A.; PODELL, Sheila; NARASINGARAO, Priya, ALLEN Eric E. Xenorhodopsins, an enigmatic new class of microbial rhodopsins horizontally transferred between Archaea and Bacteria. S. 1–20. Biology Direct [online]. 10. říjen 2011 [cit. 2011-10-13]. Svazek 6, čís. 52, s. 1–20. Dostupné v archivu pořízeném z originálu dne 2011-11-18. PDF [1]. ISSN 1745-6150. DOI 10.1186/1745-6150-6-52. (anglicky)
- ↑ Who named it http://www.whonamedit.com/doctor.cfm/2564.html
- ↑ Who http://mw1.meriam-webster.com/medical/mullerian[nedostupný zdroj]
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Rodopsin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Rodopsin na Wikimedia Commons
Média použitá na této stránce
Sensory rhodopsin II (1gue.pdb) embedded in the membrane with transducin (1got.pdb) under it. Rhodopsin is colored in a rainbow with the N-terminus red and the C-terminus blue. There is a bound retinal on the inside that I've colored black for ease of visualization. For the transducin, the Gt-alpha subunit is red, beta is blue and gamma is yellow. I've drawn in pseudo anchoring sites in black. The Gt-alpha subunit has a bound GDP that is colored by atom. The protein structures were created using UCSF chimera and then placed together in adobe illustrator. This illustration is entirely my own using the publicly available pdb data. I'm releasing it into the public domain since I couldn't find any nice illustrations of a rhodopsin and transducin.
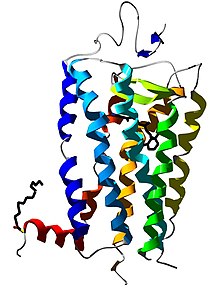
3D structure of bovine rhodopsin. Derived from the 2.6 Å crystal stucture of rhodopsin (1L9H). Structural informations were obtained from pdb.org and modelled using spdbv/POV Ray.
Blue: TMI.
Lightblue: TMII.
Cyan: TMIII.
Green: TMIV.
Yellow: TMVV.
Organge: TMVI.
Red-orange: TMVII.
Red: Hx8.