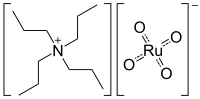
Ruthenistan tetrapropylamonný
| Ruthenistan tetrapropylamonný | |
|---|---|
 | |
| Obecné | |
| Systematický název | ruthenistan tetrapropylamonný |
| Funkční vzorec | (CH3CH2CH2)4N+RuO - 4 |
| Sumární vzorec | C12H28NRuO4 |
| Vzhled | zelená pevná látka |
| Identifikace | |
| Registrační číslo CAS | 114615-82-6 |
| PubChem | 127020979 |
| SMILES | CCC[N+](CCC)(CCC)CCC.O=[Ru](=O)([O-])=O |
| InChI | 1/C12H28N.4O.Ru/c1-5-9-13(10-6-2,11-7-3)12-8-4;;;;;/h5-12H2,1-4H3;;;;;/q+1;;;;-1;/rC12H28N.O4Ru/c1-5-9-13(10-6-2,11-7-3)12-8-4;1-5(2,3)4/h5-12H2,1-4H3;/q+1;-1 |
| Vlastnosti | |
| Molární hmotnost | 351,43 g/mol |
| Teplota rozkladu | 160 °C (433 K) |
| Bezpečnost | |
| [1] | |
| H-věty | H272 H315 H319 H335[1] |
| P-věty | P210 P220 P221 P261 P264 P271 P280 P302+352 P304+340 P305+351+338 P312 P321 P332+313 P337+313 P362 P370+378 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Ruthenistan tetrapropylamonný (zkráceně TPAP nebo TPAPR) je chemická sloučenina se vzorcem N(C3H7)4RuO4, používaná v organické syntéze. Jedná se o sůl tetrapropylamonného kationtu s ruthenistanovým aniontem, RuO -
4 .
Použití
Oxid rutheničelý je velmi silným oxidačním činidlem, TPAP, jeho jednoelektronově redukovaný derivát, je mírnější. Primární alkoholy oxiduje na aldehydy,[2] sekundární alkoholy se pak přeměňují na ketony.[3]
Při použití většího množství katalyzátoru a kooxidantu a přidání dvou ekvivalentů vody lze primární alkoholy oxidovat až na karboxylové kyseliny. V tomto případě se vytváří hydrát geminálního diolu, který se poté znovu oxiduje.[4]
Vodu vznikající při oxidaci je možné odstranit pomocí molekulárních sít. TPAP je nákladný, ovšem postačuje použití katalytických množství. Průběh katalytického cyklu zajišťuje stechiometrický kooxidant, jako například N-methylmorfolin-N-oxid[5] nebo molekulární kyslík.[6]
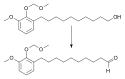
![Oxidace alkoholu na aldehyd pomocí 0,06 ekvivalentů TPAP a 1,7 ekvivalentů N-methylmorfolin-N-oxidu za použití molekjulárních sít; rozpouštědlem je dichlormethan.[7]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/ce/TPAPsvg.svg/250px-TPAPsvg.svg.png)
TPAP se také používá ke štěpení vicinálních diolů na aldehydy.[3]
Reference
V tomto článku byl použit překlad textu z článku Tetrapropylammonium perruthenate na anglické Wikipedii.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/127020979
- ↑ Steven V. Ley; Joanne Norman; William P. Griffith; Stephen P. Marsden. Tetrapropylammonium perruthenate, Pr4N+RuO4−, TPAP: A catalytic oxidant for organic synthesis. Synthesis. 1994, s. 639–666. DOI 10.1055/s-1994-25538.
- ↑ a b Steven V. Ley; Joanne Norman; Anthony J. Wilson. Encyclopedia of Reagents for Organic Synthesis. doi.wiley.com. John Wiley & Sons, 2011. Dostupné online. ISBN 978-0-471-93623-7. DOI 10.1002/047084289x.rt074.pub2.
- ↑ Z. Xu; C. W. Johannes; A. F. Houri; D. S. La; D. A. Cogan; G. E. Hofilena; A. H. Hoveyda. Applications of Zr-catalyzed carbomagnesation and Mo-catalyzed macrocyclic ring closing metathesis in asymmetric synthesis. Enantioselective total synthesis of Sch 38516 (Fluvirucin B1). Journal of the American Chemical Society. 1997, s. 10302–10316. DOI 10.1021/ja972191k.
- ↑ William P. Griffith; Steven V. Ley; Gwynne P. Whitcombe; Andrew D. White. Preparation and use of tetra-n-butylammonium per-ruthenate (TBAP reagent) and tetra-n-propylammonium per-ruthenate (TPAP reagent) as new catalytic oxidants for alcohols. Journal of the Chemical Society, Chemical Communications. 1987, s. 1625–1627. DOI 10.1039/C39870001625.
- ↑ Roman Lenz; Steven V. Ley. Tetra-n-propylammonium perruthenate (TPAP)-catalysed oxidations of alcohols using molecular oxygen as a co-oxidant. Journal of the Chemical Society, Perkin Transactions. 1997, s. 3291–3292. DOI 10.1039/A707339I.
- ↑ John A. Hadfield; Alan T. McGown; John Butler. A high-yielding synthesis of the naturally occurring antitumour agent irisquinone. Molecules. 2000, s. 82–88. Dostupné online. DOI 10.3390/50100082.
Externí odkazy
 Obrázky, zvuky či videa k tématu Ruthenistan tetrapropylamonný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Ruthenistan tetrapropylamonný na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Autor: V8rik, Licence: CC BY-SA 3.0
Oxidation of alcohol to aldehyde with TPAP (0.06 eq.) and N-methylmorpholine N-oxide (1.7 eq.)