Silabenzen
| Silabenzen | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | silin |
| Sumární vzorec | C5H6Si |
| Identifikace | |
| Registrační číslo CAS | 289-77-0 |
| PubChem | 136138 |
| SMILES | C1=CC=[SiH]C=C1 |
| InChI | InChI=1S/C5H6Si/c1-2-4-6-5-3-1/h1-6H |
| Vlastnosti | |
| Molární hmotnost | 94,187 g/mol |
Některá data mohou pocházet z datové položky. | |
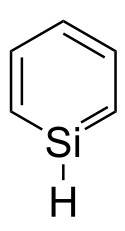
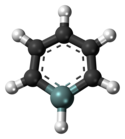
Silabenzen je aromatická heterocyklická sloučenina tvořená šestičlenným kruhem, kde je v molekule benzenu jeden atom uhlíku nahrazen křemíkem. Nahrazením dalších uhlíkových atomů lze odvodit disilabenzen (který má tři teoreticky možné izomery), trisilabenzen (3 izomery) a další.
Silabenzeny byly zahrnuty do mnoha teoretických a syntetických studií, kde bylo zkoumáno, jestli jsou analogy benzenu obsahující prvky 14. skupiny, silabenzen, stannabenzen a germabenzen, aromatické.
I když je známo několik heteroaromatických sloučenin s cykly obsahujícími atomy dusíku, kyslíku či síry, tak je silabenzen považován za nestabilní a neizolovatelnou sloučeninu, kterou lze zachytit na delší dobu pouze v matricích za nízkých teplot nebo jako Dielsův–Alderův adukt. Byly ovšem vyvinuty reakce, kterými vznikají kineticky stabilizované silabenzeny a těžší analogy benzenu, například germaniové.
Příprava

Bylo provedeno několik pokusů o přípravu stabilních silabenzenů pomocí objemných substituentů, jako jsou terc nebo trimethylsilylové skupiny, produkty však reagovaly mezi sebou za tvorby dimerů, a to i při nízkých teplotách (pod -100 °C), což způsobovala značná reaktivita vazeb π. V roce 1978 byla popsána pyrolýza 1-methyl-1-allyl-1-silacyklohexa-2,4-dienu v křemenné trubici zahřívané na 428 °C, kde byl reaktantem a zároveň nosným plynem ethyn nebo perfluorbut-2-yn. Vznikaly přitom retroenovými reakcemi Dielsovy–Alderovy adukty s 1-methyl-1-silylbenzenem, 1-methyl-1-silabicyklo[2.2.2]oktatrien či 1-methyl-2,3-bis(trifluormethyl)-1-silabicyklo[2.2.2]oktatrien.[1]
Na základě výpočtů provedených v roce 2013 byl vytvořen způsob přípravy stabilních silabenzenů za laboratorní teploty pomocí Brookova přesmyku.[2]
[1,3]-Si → O přesmyk trimethylsilylovaných a triisopropylsilylovaných prekurzorů za přítomnosti tetraedrických atomů křemíku v sousedství karbonylového kyslíku vedla k tvorbě aromatických silabenzenů Brookova typu.
Na přípravu naftalenového analogu 2-silanaftalenu,[3][4] první popsané silaaromatické sloučeniny, roku 2000 navázala stejná výzkumná skupina syntézou tepelně stálého silabenzenu, přičemž byly využity sterické efekty nové chránicí skupiny.[5]
V roce 2002 byl připraven derivát 9-silaantracenu[6] a také 1-silanaftalenu.[7] Ve stejném roce se rovněž podařilo získat 1,4-disilabenzen.[8]
Rok 2007 přinesl syntézu 1,2-disilabenzenu formální [2+2+2] cyklotrimerizací disilynu (sloučeniny s trojnou vazbou Si-Si, křemičitým analogem ethynu) s fenylacetylenem.[9]
Některé teoretické studie naznačují, že symetrický 1,3,5-trisilabenzen by měl být stabilnější než 1,2-disilabenzen.[10]
Vlastnosti a reakce
Izolované silabenzeny reagují s různými sloučeninami v pozicích 1,2- nebo 1,4- za vzniku dienových produktů, čímž se narušuje aromaticita silabenzenu, jelikož benzen s elektrofily reaguje za tvorby substituovaných benzenů. Křemík patří mezi polokovy a tak je vazba Si-C u silabenzenu značně polarizovaná a snadno se štěpí. Silabenzen je také citlivý na ultrafialové záření, jehož působením se mění na valenční izomer, nazývaný silabenzvalen. Teoretické výpočty i chemický posun v NMR spektrech silabenzenů ovšem ukazuje, že jde o aromatické sloučeniny, i když reagují jinak než benzen a jiné běžné aromatické sloučeniny.
Hexasilabenzen
Podle výpočtu by plně křemíkový analog benzenu, hexasilabenzen (Si6H6) měl mít šestičlennou symetrii[11] nebo židličkovou konformaci.[12]
Ukázalo se, že odchylky molekul hexasilabenzenu od rovinného tvaru jsou způsobeny pseudo Jahnovým–Tellerovým efektem.[13]
Roku 1993 byl připraven stabilní hexasilaprisman[14] a v roce 2010 sloučenina izomerní s hexasilabenzenem,[15] která byla popsána jako stabilní a pomocí rentgenové krystalografie bylo zjištěno, že má židličkovitý tricyklický křemíkový řetězec.
Snaha o přípravu rovinného Si6 analogu benzenu byla rozšířena na aniontové cykly a struktury obsahující atomy lithia místo vodíků.[16]
Výpočty na základě teorie funkcionálu hustoty bylo zjištěno, že u řady rovinných a trojrozměrných struktur se souhrnnými vzorci Si6Li2-8 je globální minimum u rovinného kruhu Si6Li6. Tento konkrétní kruh má D2h symetrii se čtyřmi lithnými kationty mezi sousedními atomy křemíku, čímž vznikají tricentrické dvouelektronové vazby, a dva další ionty Li+ nad a pod středem roviny kruhu. Vysoce symetrický D6h strukturní analog hexalithiumbenzenu[17] má rozdíl energie 2,04 eV oproti minimu.[18]
Teorie funkcionálu hustoty byla také využita ke zkoumání aromaticity, jako se dá použít u mnoha různých molekul[19] funkcionál hybridní hustoty B3LYP.[20] Jako kritérium ke zkoumání byly vybrány chemické posuny nezávislé na jádru.[21] Globální minimum (D2h symetrický kruh) a D6h symetrický kruh měly hodnoty −3,95 a −5,95; záporné hodnoty ukazují na aromaticitu.
Později bylo s využitím nového genetického algoritmu spočítáno, že trojrozměrná struktura Si6Li6 je stabilnější než rovinné izomery.[22]
Odkazy
Související články
- Šestičlenné aromatické kruhy s jedním atomem uhlíku nahrazeným jinou skupinou: borabenzen, boratabenzen, silabenzen, germabenzen, stannabenzen, pyridin, fosforin, arsabenzen, bismabenzen, pyrylium, thiopyrylium, selenopyrylium, telluropyrylium
Reference
V tomto článku byl použit překlad textu z článku Silabenzene na anglické Wikipedii.
- ↑ T. J. Barton; G. T. Burns. Unambiguous generation and trapping of a silabenzene. Journal of the American Chemical Society. 1978, s. 5246. DOI 10.1021/ja00484a075.
- ↑ Alvi Muhammad Rouf; Burkhard O. Jahn; Henrik Ottosson. Computational Investigation of Brook-Type Silabenzenes and Their Possible Formation through [1,3]-Si→O Silyl Shifts. Organometallics. 2013-01-14, s. 16–28. DOI 10.1021/om300023s.
- ↑ N. Tokitoh; K. Wakita; R. Okazaki; S. Nagase; P. von Ragué Schleyer; H. Jiao. A Stable Neutral Silaaromatic Compound, 2-{2,4,6-Tris[bis(trimethylsilyl)methyl]phenyl}- 2-Silanaphthalene. Journal of the American Chemical Society. 1997, s. 6951–6952. DOI 10.1021/ja9710924.
- ↑ K. Wakita; N. Tokitoh; R. Okazaki; S. Nagase; P. von Ragué Schleyer; H. Jiao. Synthesis of Stable 2-Silanaphthalenes and Their Aromaticity. Journal of the American Chemical Society. 1999, s. 11336–11344. DOI 10.1021/ja992024f.
- ↑ K. Wakita; N. Tokitoh; R. Okazaki; N. Takagi; S. Nagase. Crystal Structure of a Stable Silabenzene and Its Photochemical Valence Isomerization into the Corresponding Silabenzvalene. Journal of the American Chemical Society. 2000, s. 5648–5649. DOI 10.1021/ja000309i.
- ↑ N. Takeda; A. Shinohara; N. Tokitoh. The First Stable 9-Silaanthracene. Organometallics. 2002, s. 256–258. DOI 10.1021/om0108301.
- ↑ N. Takeda; A. Shinohara; N. Tokitoh. Synthesis and Properties of the First 1-Silanaphthalene. Organometallics. 2002, s. 4024–4026. DOI 10.1021/om0205041.
- ↑ Y. Kabe; K. Ohkubo; H. Ishikawa; W. Ando. 1,4-Disila(Dewar-benzene) and 1,4-Disilabenzene: Valence Isomerization of Bis(alkylsilacyclopropenyl)s. Journal of the American Chemical Society. 2000, s. 3775–3776. DOI 10.1021/ja9930061.
- ↑ R. Kinjo; M. Ichinohe; A. Sekiguchi; N. Takagi; M. Sumimoto; S. Nagase. Reactivity of a Disilyne RSi≡SiR (R=SijPr(CH(SiMe3)2)2) Toward π-Bonds: Stereospecific Addition and a New Route to an Isolable 1,2-Disilabenzene. Journal of the American Chemical Society. 2000, s. 7766–7767. DOI 10.1021/ja072759h. PMID 17542592.
- ↑ K. K. Baldridge; O. Uzan; J. M. L. Martin. The Silabenzenes: Structure, Properties, and Aromaticity. Organometallics. 2000, s. 1477–1487. DOI 10.1021/om9903745.
- ↑ M. J. S. Dewar; D. H. Lo; C. A. Ramsden. Ground States of Molecules. XXIX. MINDO/3 Calculations of Compounds Containing Third Row Elements. Journal of the American Chemical Society. 2000, s. 1311–1318. DOI 10.1021/ja00839a005.
- ↑ S. Nagase; H. Teramae; T. Kudo. Hexasilabenzene (Si6H6). Is the Benzene-Like D6h Structure Stable?. The Journal of Chemical Physics. 1987, s. 4513–4517. DOI 10.1063/1.452726. Bibcode 1987JChPh..86.4513N.
- ↑ A. Ivanov; A. Boldyrev. Si6−nCnH6 (n = 0-6) Series: When Do Silabenzenes Become Planar and Global Minima?. The Journal of Physical Chemistry A. 2012, s. 9591–9598. DOI 10.1021/jp307722q. PMID 22946702. Bibcode 2012JPCA..116.9591I.
- ↑ A. Sekiguchi; T. Yatabe; C. Kabuto; H. Sakurai. Chemistry of Organosilicon Compounds. 303. The "Missing" Hexasilaprismane: Synthesis, X-Ray Analysis and Photochemical Reactions. Journal of the American Chemical Society. 1993, s. 5853–5854. DOI 10.1021/ja00066a075.
- ↑ K. Abersfelder; A. White; H. Rzepa; D. Scheschkewitz. A Tricyclic Aromatic Isomer of Hexasilabenzene. Science. 2010, s. 564–566. DOI 10.1126/science.1181771. PMID 20110501. Bibcode 2010Sci...327..564A.
- ↑ M. Takahasi; Y. Kawazoe. Theoretical Study on Planar Anionic Polysilicon Chains and Cyclic Si6H Anions with D6h Symmetry. Organometallics. 2005, s. 2433–2440. DOI 10.1021/om050025c.
- ↑ Y. Xie; H. Schaefer. Hexalithiobenzene: a D6h Equilibrium Geometry with Six Lithium Atoms in Bridging Positions. Chemical Physics Letters. 1991, s. 563–567. DOI 10.1016/0009-2614(91)87104-J. Bibcode 1991CPL...179..563X.
- ↑ A. Zdetsis. Stabilization of Flat Aromatic Si 6 Rings Analogous to Benzene: Ab initio Theoretical Prediction. The Journal of Chemical Physics. 2007. DOI 10.1063/1.2805366. PMID 18067356. Bibcode 2007JChPh.127u4306Z.
- ↑ F. De Proft; P. Geerlings. Conceptual and Computational DFT in the Study of Aromaticity. Chemical Reviews. 2001, s. 1451–1464. DOI 10.1021/cr9903205. PMID 11710228.
- ↑ M. Nedel; K. Houk; L. Nedel; E. Vogel; H. Jiao; P. von Rague Schleyer. Bond Alternation and Aromatic Character in Cyclic Polyenes: Assessment of Theoretical Methods for Computing the Structures and Energies of Bismethano[14]annulenes. The Journal of Physical Chemistry A. 1998, s. 7191–7198. DOI 10.1021/jp9820976. Bibcode 1998JPCA..102.7191N.
- ↑ P. von Rague Schleyer; C. Maerker; A. Dransfeld; H. Jiao; N. van Eikema Hommes. Nucleus-Independent Chemical Shifts: A Simple and Efficient Aromaticity Probe. Journal of the American Chemical Society. 1996, s. 6317–6318. DOI 10.1021/ja960582d. PMID 28872872.
- ↑ J. Santos; M. Contreras; G. Merino. Structure and Stability of Si6Li6: Aromaticity vs Polarizability. Chemical Physics Letters. 2010, s. 172–174. DOI 10.1016/j.cplett.2010.07.026. Bibcode 2010CPL...496..172S.
Média použitá na této stránce
Chemical structure of silabenzene
Autor: Dissolution, Licence: CC BY-SA 3.0
Hexasilabenzene isomer DOI 10.1021/ja00839a005
Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the silabenzene molecule, a compound similar to benzene, with one of the carbons replaced by silicon.
Colour code:
- Carbon, C: black
- Hydrogen, H: white
- Silicon Si: blue-grey