Silylen
| Silylen | |
|---|---|
 Strukturní vzorec obecného silylenu | |
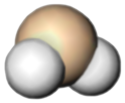
 Model základní molekuly | |
| Obecné | |
| Systematický název | silyliden |
| Sumární vzorec | SiH2 |
| Identifikace | |
| Registrační číslo CAS | 13825-90-6 |
| PubChem | 6327230 |
| SMILES | [SiH2] |
| InChI | 1S/H2Si/h1H2 |
| Vlastnosti | |
| Molární hmotnost | 30,101 g/mol |
Některá data mohou pocházet z datové položky. | |
Silylen je anorganická sloučenina se vzorcem SiH2, křemíkový analog methylenu, nejjednoduššího karbenu.V plynném skupenství je stabilní, ovšem při kondenzaci značně reaktivní. Na rozdíl od karbenů, které mohou vytvářet singletový nebo tripletový stav, jsou silylen a jeho deriváty vždy singletové.
Jako silyleny se označují deriváty základního silylenu, kde jsou atomy vodíku nahrazeny jinými funkčními skupinami;[1] většina jich obsahuje amido- (NR2) nebo alkylové a/nebo arylové skupiny.[2][3]
Silyleny byly navrženy jako reaktivní meziprodukty některých reakcí. Jedná se o analogy karbenů.[4]
Vznik a vlastnosti
Silyleny vznikají termolýzami nebo fotolýzami polysilanů, reakcemi křemíkových atomů (inserčními, adičními nebo odštěpením), pyrolýzami silanů, nebo redukcemi 1,1-dihalogensilanů. Předpokládalo se, že i přeměna elementárního Si na čtyřvazný Si ve sloučeninách probíhá přes silylenové meziprodukty:
- Si + Cl2 → SiCl2
- SiCl2 + Cl2 → SiCl4
Podobné meziprodukty se vyskytují v Müllerově–Rochowově procesu, kde reaguje chlormethan s křemíkem.
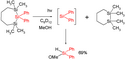
Prvním pozorovaným silylenem byl dimethylsilylen, získaný dechlorací dimethyldichlorsilanu:[5]
- SiCl2(CH3)2 + 2 K → Si(CH3)2 + 2 KCl
Dimethylsilylen lze připravit dechlorací za přítomnosti trimethylsilanu, zachyceným produktem je ale pentamethyldisilan:
- Si(CH3)2 + HSi(CH3)3 → (CH3)2Si(H)−Si(CH3)3
N izolovatelným za povrchové teploty je například N,N′-di-terc-butyl-1,3-diaza-2-silacyklopent-4-en-2-yliden, který připravil Michael K. Denk v roce 1994.[6]

Silylen je stabilizován dodáváním π-elektronů z α-amidocenter. Dehalogenace diorganokřemíkových dihalogenidů jsou dobře prozkoumanou skupinou reakcí.[7]
Podobné reakce
V jedné studii byl získán difenylsilylen fotolýzou trisilanu:[8]
Silylen lze pozorovat pomocí ultrafialovo-viditelné spektroskopie na 520 nm, jeho chemický poločas činí 2 μs. Pokud se do reakční směsi přidá methanol, tak zapůsobí jako chemická past s rychlostní konstantou druhého řádu 13×1010 mol−1 s−1.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Silylene na anglické Wikipedii.
- ↑ Yoshiyuki Mizuhata; Takahiro Sasamori; Norihiro Tokitoh. Stable Heavier Carbene Analogues. Chemical Reviews. 2009, s. 3479–3511. DOI 10.1021/cr900093s. PMID 19630390.
- ↑ a b Selvarajan Nagendran; Herbert W. Roesky. The Chemistry of Aluminum(I), Silicon(II), and Germanium(II). Organometallics. 2008, s. 457–492. DOI 10.1021/om7007869.
- ↑ Michael Haaf; Thomas A. Schmedake; Robert West. Stable Silylenes. Accounts of Chemical Research. 2000, s. 704–714. DOI 10.1021/ar950192g. PMID 11041835.
- ↑ Peter Gaspar; R. West. The Chemistry of Organic Silicon Compounds. [s.l.]: [s.n.], 1998. ISBN 0471967572. DOI 10.1002/0470857250.ch43. Kapitola Silylenes, s. 2463–2568.
- ↑ P. S. Skell; E. J. Goldstein. Dimethylsilene: CH3SiCH3. Journal of the American Chemical Society. 1964, s. 1442–1443. DOI 10.1021/ja01061a040.
- ↑ Michael Denk, Robert Lennon, Randy Hayashi, Robert West, Alexander V. Belyakov, Hans P. Verne, Arne Haaland, Matthias Wagner, Nils Metzler. Synthesis and Structure of a Stable Silylene. Journal of the American Chemical Society. 1994, s. 2691–2692. DOI 10.1021/ja00085a088.
- ↑ Matthias Driess; Shenglai Yao; Markus Brym; Christoph Van Wüllen; Dieter Lentz. A New Type of N-Heterocyclic Silylene with Ambivalent Reactivity. Journal of the American Chemical Society. 2006, s. 9628–9629. DOI 10.1021/ja062928i. PMID 16866506.
- ↑ Andrey G. Moiseev; William J. Leigh. Diphenylsilylene. Journal of the American Chemical Society. 2006, s. 14442–14443. DOI 10.1021/ja0653223. PMID 17090011.
Související články
- N
- Sileny, R2Si=SiR2
- Silyliové ionty, protonované silyleny
Média použitá na této stránce
Space-filling model of the silylene.
Diagram showing the chemical structure of a generic silylene (analogue of a carbene)
Autor: Acbrown49, Licence: CC BY-SA 4.0
Chemdraw image of decamethylsilicocene