Simmonsova–Smithova reakce
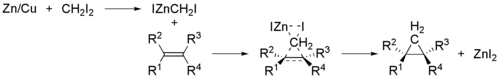
Simmonsova–Smithova reakce je organická reakce spočívající v tvorbě derivátu cyklopropanu reakcí organozinkového karbenoidu s alkenem nebo alkynem.[1][2][3] Objevili ji Howard Ensign Simmons a Ronald D. Smith.
Při této reakci se používají methylenové radikály jako meziprodukty, které se současně navazují na oba uhlíky alkenu, takže se nemění konfigurace dvojné vazby a reakce je stereospecifická.[4]
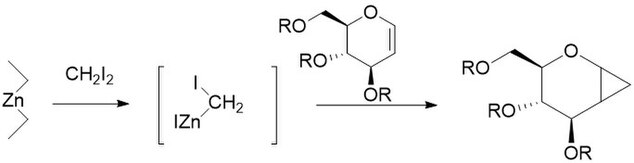
Příkladem může být reakce cyklohexenu, dijodmethanu a slitiny mědi se zinkem, v podobě jodmethyljodidu zinečnatého, ICH2ZnI, za vzniku norkaranu (bicyklo[4.1.0]heptanu).[5][6]
Simmonsova–Smithova reakce se obvykle upřednostňuje oproti jiným způsobům cyklopropanace, ovšem může být nákladná kvůli vysoké ceně dijodmethanu. Byly vyvinuty i méně nákladné obměny, využívající například dibrommethan,[7] diazomethan a nebo jodid zinečnatý.[8]
Reaktivitu lze navýšit i použitím Furukawovy modifikace, kdy se slitina zinku a mědi nahradí diethylzinkem.[9]
Simmonsovy–Smithovy reakce bývají ovlivňovány sterickými efekty, cyklopropanace tak obvykle probíhá na stericky méně zatížené straně substrátu.[10][11] Pokud se ovšem na substrátu nachází hydroxylový substituent blízko dvojné vazby, tak se na něj navazuje zinek, což řídí cyklopropanaci do polohy cis oproti hydroxylu, která nemusí odpovídat cyklopropanaci na stericky nejvýhodnějším místě:[12]
Asymetrické Simmonsovy–Smithovy reakce
Přestože jsou asymetrické cyklopropanace, založené na použití diazosloučenin, známy od roku 1966 (viz bisoxazolinové ligandy), tak asymetrické Simmonsovy–Smithovy reakce byly poprvé popsány až v roce 1992, kdy šlo o reakci cinnamylalkoholu s diethylzinkem, dijodmethanem a chirálním disulfonamidem v dichlormethanu.[13]
Hydroxylováskupina zachytává zinek. Byl vytvořen 3D model podobné reakce[14] viz [1].
V jiné variantě byl ligand odvozen od salenu a v reakční směsi se také nacházel diisobutylaluminiumhydrid, sloužící jako Lewisova kyselina:[15]
Rozsah a omezení
Nechirální alkeny
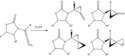
Simmonsovými–Smithovými reakcemi mohou být bez potíží cyklopropanovány jednoduché alkeny. Nefunkcionalizované nechirální alkenxy se nejlépe cyklopropanují pomocí Furukawovy varianty (viz níže), kdy jsou přítomny Et2Zn a CH2I2 v 1,2-dichlorethanu.[16] Cyklopropanace alkenů aktivovaných skupinami dodávajícími elektrony jsou rychlé a snadné; například se často používají enolethery, jako jsou trimethylsilyloxy-substitované alkeny, protože takové reakce mívají vysoké výtěžky.[17]

Přestože halogeny odtahují elektrony, tak se dá lehce cyklopropanovat i řada vinylhalogenidů, přičemž vznikají fluorované, bromované and jodované cyklopropany.[18][19]

Cyklopropanace N-substituovaných alkenů ztěžují vedlejší reakce v podobě N. Zabránit se jim dá navázáním chránicí skupiny na dusík, navázání skupin odtahujících elektrony ale snižuje nukleofilitu alkenu, čímž klesá výtěžnost. Silně elektrofilní činidla, jako například CHFI2, vykazují v takových případech oproti dijodmethanu vyšší výtěžky.[20]
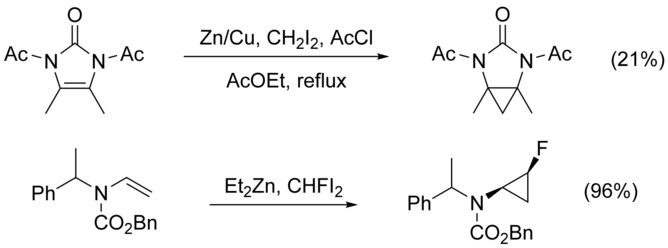
Polyeny
Bez přítomnosti řídicích skupin u polyenů nedochází k výraznější chemoselektivitě;[21] je-li však jeden alken výrazně nukleofilnější než ostatní, tak bude reagovat přednostně, což se projevuje například u enoletherů.[22]
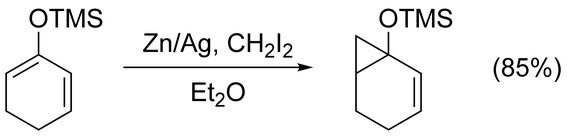
Využitelné funkční skupiny
Při Simmonsových–Smithových reakcích lze použít mnoho různých funkčních skupin, například do reakcí řízených halogenalkylzinkovými sloučeninami mohou být zapojeny alkyny, alkoholy, ethery, aldehydy, ketony, karboxylové kyseliny a jejich deriváty, estery kyseliny uhličité, sulfony, sulfonáty, silany a stannany; běžně se však objevují vedlejší reakce.
Většinu vedlejších reakcí způsobuje Lewisovská kyselost vedlejšího produktu, ZnI2. V reakcích vytvářejících sloučeniny citlivé na přítomnost kyselin se může přidávat nadbytek Et2Zn, který převádí vznikající ZnI2 na méně kyselý EtZnI. alší možnost představuje použití pyridinu a nadbytku činidel.[23]
V Simmonsových–Smithových reakcích dochází také k methylacím heteroatomů, způsobených elektrofilitou zinkových karbenoidů, například dlouhé reakční časy vedou téměř vždy k methylacím alkoholů.[24]
Et2Zn a CH2I2 reagují s allylovými thioethery na sirné ylidy, které poté mohou vstupovat do [2,3]-sigmatropních přesmyků a neúčastní se cyklopropanace alkenu stejné molekuly, jestliže není použito přebytečné množství Simmonsova–Smithova činidla.[25]
Obměny
Existuje několik obměn Simmonsovy–Smithovy reakce, týkajících se jak organozinkového katalyzátoru, tak i přidaného uhlíku.
Furukawova varianta
Furukawova varianta nahrazuje slitinu zinku a mědi dialkylzinkovými sloučeninami; jako nejvhodnější se ukázal diethylzinek, Et2Zn. Tato obměna byla vyvinuta v roce 1968 jako způsob převodu kationtově polymerizovatelných alkenů, například vinyletherů, na příslušné cyklopropany.[9]
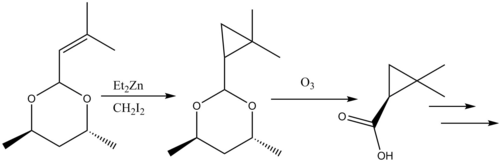
Tento postup je také užitečný pro cyklopropanace sacharidů.[26]
Furukawova podoba reakce je, stejně jako ta původní, stereospecifická, často probíhá mnohem rychleji. Diethylzinek je ale samozápalný a musí se tak s ním zacházet opatrně.[27]
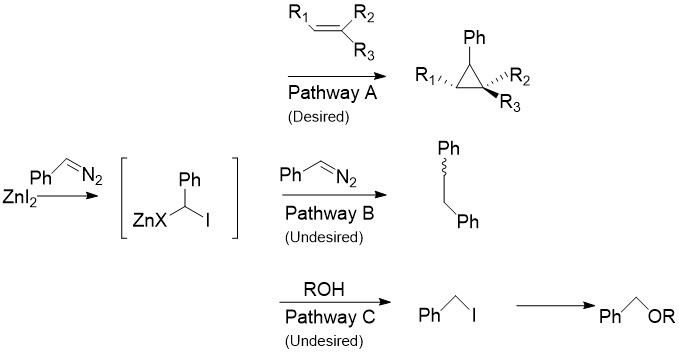
Charettova varianta
Charettova varianta nahrazuje obvykle používaný dijodmethan (CH2I2) aryldiazosloučeninami, například fenyldiazomethanem.[28]
Působením steichiometrických množství zinečnatých halogenidů se vytváří organozinkové sloučeniny podobné výše zmíněným karbenoidům. Tyto sloučeniny mohou reagovat s téměř všemi alkeny a alkyny, včetně styrenů a nenasycených alkoholů; při běžných Simmonsových-Smithových reakcích jsou alkoholy deprotonovány. Zapojit se ovšem mohou i do reakcí s výchozími diazosloučeninami, kde vzniká cis- nebo trans- 1,2-difenylethen. Meziprodukt může navíc reagovat s alkoholy na jodfenylmethan, který poté vstupuje do SN2 reakce za vzniku ROCHPh.
Činidla neobsahující zinek
Přestože to není běžné, tak lze podobné Simmonsovy-Smithovy reakce jako se sloučeninami zinku provést i pomocí sloučenin hliníku a samaria za přítomnosti CH2IX.[29] Jejich pomocí se dají selektivně ve vzájemné směsi cyklopropanovat allylové alkoholy a izolované alkeny. Jod- a chlormethylsamariumjodid v tetrahydrofuranu (THF) jsou velmi vhodnými činidly pro selektivní cyklopropanace allylalkoholů, přičemž reakci pravděpodobně řídí chelatace na hydroxylovou skupinu.[30] Dialkyl(jodmethyl)hliníkové sloučeniny v dichlormethanu (CH2Cl2) zase selektivně cyklopropanují izolované alkeny.[31]
Specifita těchto činidel umožňuje navazování cyklopropanových skupin do polynenasycených struktur, které se s použitím zinkových činidel cyklopropanují úplně a neselektivně, například i-Bu3Al cyklopropanuje geraniol do polohy 6, zatímco Sm/Hg do polohy 2, jak je zobrazeno na následujícím obrázku.

Obě reakce vyžadují téměř stechiometrická množství organokovových sloučenin a Sm/Hg se musí aktivovat silně toxickým HgCl2.
Syntetická využití
Většina moderních postupů založených na Simmonsových–Smithových reakcích využívá Furukawovu variantu. Níže je uvedeno několik významných příkladů.
Příprava γ-ketoesterů
Furukawovaobměna Simmonsovy-Smithovy reakce může sloužit k tvorbě cyklopropanových reaktivních meziproduktů v rámci přípravy γ-ketoesterů z β-ketoesterů. Simmonsovo-Smithovo činidlo se nejprve naváže na karbonylovou skupinu vedle α-uhlíku pseudoenolu. Následně se z takto vzniklého meziproduktu vytvoří cyklopropylová sloučenina, která se rychle rozkládá na výsledný produkt.[32][33]

Tvorba amido-spiro[2.2]pentanů z allenamidů
Furukawova varianta může také cykropropanovat dvojné vazby allenamidů za vzniku amido-spiro[2.2]cyklopentanů, které obsahují dva cykropropanové kruhy s jedním společným atomem uhlíku. Vytváří se i produkt monocyklopropanace.[34][35]

Syntézy přírodních látek
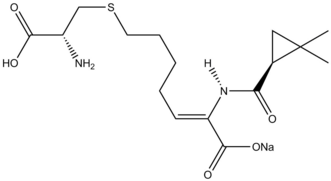
Cyklopropanace byly zahrnuty do několika totálních syntéz přírodních látek,[36] jako je například cilastatin, inhibitor β-laktamázy. Allylová skupina na výchozí molekule byla cyklopropanována pomocí Simmonsovy-Smithovy reakce a následně proběhlo odvázání chránicí skupiny z karboxylové kyseliny ozonolýzou, čímž se vytvořil prekurzor.
Výroba léčiv
Simmonsova–Smithova reakce je součástí výroby GSK1360707F a ropanicantu.[37]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Simmons–Smith reaction na anglické Wikipedii.
- ↑ Howard Ensign Simmons; R. D. Smith. A New Synthesis of Cyclopropanes from Olefins. Journal of the American Chemical Society. 1958, s. 5323–5324. DOI 10.1021/ja01552a080.
- ↑ H. E. Simmons; R. D. Smith. A New Synthesis of Cyclopropanes. Journal of the American Chemical Society. 1959, s. 4256–4264. DOI 10.1021/ja01525a036.
- ↑ J. M. Denis; J. M. Denis; J. M. Conia. Improved Simmons–Smith Reactions. Synthesis. 1972, s. 549–551. DOI 10.1055/s-1972-21919.
- ↑ A. B. Charette; A. Beauchemin. Simmons-Smith Cyclopropanation Reaction. Organic Reactions. 2001, s. 1. ISBN 978-0471264187. DOI 10.1002/0471264180.or058.01.
- ↑ SMITH, R. D.; SIMMONS, H. E. Norcarane. Org. Synth.. Dostupné online. (anglicky); Coll. Vol.. S. 855. (anglicky)
- ↑ ITO, Y.; FUJII, S.; NAKATUSKA, M.; KAWAMOTO, F.; SAEGUSA, T. One-Carbon Ring Expansion Of Cycloalkanones To Conjugated Cycloalkenones: 2-Cyclohepten-1-one. Org. Synth.. 1988. Dostupné online. (anglicky); Coll. Vol.. S. 327. (anglicky)
- ↑ Bodo Fabisch; Terence N. Mitchell. An inexpensive modification of the Simmons-Smith reaction: The formation of bromomethylzinc bromide as studied by NMR spectroscopy. Journal of Organometallic Chemistry. 1984, s. 219–221. DOI 10.1016/0022-328X(84)80305-8.
- ↑ Georg Wittig; Frank Wingler. Über methylenierte Metallhalogenide, IV. Cyclopropan-Bildung aus Olefinen mit Bis-halogenmethyl-zink. Chemische Berichte. 1964, s. 2146–2164. DOI 10.1002/cber.19640970808.
- ↑ a b J. Furukawa; N. Kawabata; J. Nishimura. Synthesis of cyclopropanes by the reaction of olefins with dialkylzinc and methylene iodide. Tetrahedron. 1968, s. 53–58. DOI 10.1016/0040-4020(68)89007-6.
- ↑ Howard E. Simmons; Theodore L. Cairns; Susan A. Vladuchick; Connie M. Hoiness. Cyclopropanes from Unsaturated Compounds, Methylene Iodide, and Zinc-Copper Couple. Organic Reactions. 2011-03-15. Dostupné online. ISBN 978-0471264187. DOI 10.1002/0471264180.or020.01.
- ↑ C. Girard; J. M. Conia. Journal of Chemical Research. 1978, s. 182.
- ↑ Paul A. Grieco; Tomei Oguri; Chia-Lin J. Wang; Eric Williams. Stereochemistry and total synthesis of (±)-ivangulin. The Journal of Organic Chemistry. 1977, s. 4113–4118. DOI 10.1021/jo00445a027.
- ↑ Hideyo Takahashi; Masato Yoshioka; Masaji Ohno; Susumu Kobayashi. A catalytic enantioselective reaction using a C2-symmetric disulfonamide as a chiral ligand: cyclopropanation of allylic alcohols by the Et2Zn-CH2I2-disulfonamide system. Tetrahedron Letters. 1992, s. 2575–2578. DOI 10.1016/S0040-4039(00)92246-9.
- ↑ Tao Wang; Yong Liang; Zhi-Xiang Yu. Density Functional Theory Study of the Mechanism and Origins of Stereoselectivity in the Asymmetric Simmons–Smith Cyclopropanation with Charette Chiral Dioxaborolane Ligand. Journal of the American Chemical Society. 2011, s. 9343–9353. DOI 10.1021/ja111330z. PMID 21627114.
- ↑ Hiroaki Shitama; Tsutomu Katsuki. Asymmetric Simmons–Smith Reaction of Allylic Alcohols with Al Lewis Acid/N Lewis Base Bifunctional Al(Salalen) Catalyst. Angewandte Chemie International Edition. 2008, s. 2450–2453. DOI 10.1002/anie.200705641. PMID 18288666.
- ↑ S. E. Denmark; J. P. Edwards. A Comparison of (Chloromethyl)- and (Iodomethyl)zinc Cyclopropanation Reagents. The Journal of Organic Chemistry. 1991, s. 6974–6981. DOI 10.1021/jo00025a007.
- ↑ G. M. Rubottom; M. I. Lopez. Reaction of Trimethysilyl Enol Ethers with Simmons-Smith Reagent. Facile Synthesis of Trimethylsilyl Cyclopropyl Ethers and Cyclopropanols. The Journal of Organic Chemistry. 1973, s. 2097–2099. DOI 10.1021/jo00951a032.
- ↑ Morikawa, T.; Sasaki, H.; Mori, K.; Shiro, M.; Taguchi, T.; Morikawa, T.; Sasaki, H.; Mori, K.; Shiro, M.; Taguchi, T. Simmons-Smith Reactions of Fluoroallyl Alcohol Derivatives. Chemical and Pharmaceutical Bulletin (Tokyo) 1992, 40 (12), 3189
- ↑ Piers, E.; Coish, P. D. Preparation and Cyclopropanation of 2- and 3-Iodoalk-2-En-1-Ols: Synthesis of Functionalized, Stereodefined Iodocyclopropanes. Synthesis 1995, 1995 (1), 47–55
- ↑ Gagnon, J. L.; Jr, W. W. Z. Synthesis of Cis-1,5-Dimethyl-2,4-Dinitro-2,4-diazabicyclo[3.1.0]hexan-3-One and Cis-1,5-Dimethyl-2,4-Dinitro-2,4-diazabicyclo[3.2.0]heptan-3-One. Synthetic Communications 1996, 26 (4), 837–845
- ↑ E. C. Friedrich; F. Niyati-Shirkhodaee. Regioselectivity and Solvent Effects in Cyclopropanation of Alkadienes. The Journal of Organic Chemistry. 1991, s. 2202–2205. DOI 10.1021/jo00006a044.
- ↑ J. Lee; H. Kim; J. K. Cha. Diastereoselective Synthesis of Cis-1,2-Dialkenylcyclopropanols and Subsequent Oxy-Cope Rearrangement. Journal of the American Chemical Society. 1995, s. 9919–9920. DOI 10.1021/ja00144a022.
- ↑ Denis, J. M.; Girard, C.; Conia, J. M. Improved Simmons-Smith Reactions. Synthesis 1972, 1972 (10), 549–551
- ↑ I. M. Takakis; Y. E. Rhodes. Diastereoselective Cyclopropanation of Some Simple Olefinic Compounds. By-Product Formation in Excess Simmons-Smith Reagent. The Journal of Organic Chemistry. 1978, s. 3496–3500. DOI 10.1021/jo00412a017.
- ↑ T. Cohen; Z. Kosarych. Complete regio- and stereospecificity in the Lewis acid catalyzed Diels-Alder reactions of (Z)-2-methoxy-1-(phenylthio)-1,3-butadienes. Conversion of the CS configuration of an adduct to the CC configuration at the allylic position by a [2,3] sigmatropic rearrangement. The Journal of Organic Chemistry. 1982, s. 4005–4008. DOI 10.1021/jo00141a047.
- ↑ B. Halton. Advances in Strained and Interesting Organic Molecules, Volume 8. [s.l.]: [s.n.], 2000. ISBN 978-0-7623-0631-2. S. 115.
- ↑ Diethyl Zinc MSDS [online]. [cit. 2017-05-10]. Dostupné online.[nedostupný zdroj]
- ↑ Éric Lévesque; Sébastien R. Goudreau; André B. Charette. Improved Zinc-Catalyzed Simmons–Smith Reaction: Access to Various 1,2,3-Trisubstituted Cyclopropanes. Organic Letters. 2014, s. 1490–1493. DOI 10.1021/ol500267w. PMID 24555697.
- ↑ Organic Reactions Vol 58. [s.l.]: J. Wiley, 2001. Dostupné online. ISBN 978-0-471-10590-9. S. 9–10.
- ↑ G. A. Molander; L. S. Harring. Samarium-Promoted Cyclopropanation of Allylic Alcohols. The Journal of Organic Chemistry. 1989, s. 3525–3532. DOI 10.1021/jo00276a008.
- ↑ K. Maruoka; Y. Fukutani; H. Yamamoto. Trialkylaluminum-Alkylidene Iodide. A Powerful Cyclopropanation Agent with Unique Selectivity. The Journal of Organic Chemistry. 1985, s. 4412–4414. DOI 10.1021/jo00222a051.
- ↑ Yashoda Bhogadhi; Charles Zercher. Discussion Addendum for: Formation of γ-Keto Esters from β-Keto Esters: Methyl 5,5-dimethyl-4-oxohexanoate. Organic Syntheses. 2014, s. 248–259. DOI 10.15227/orgsyn.091.0248.
- ↑ Matthew Ronsheim; Ramona Hilgenkamp; Charles Zercher. Formation of γ-Keto Esters from β-Keto Esters: Methyl 5,5-dimethyl-4-oxohexanoate. Organic Syntheses. 2002, s. 146. Dostupné online. ISBN 978-0471264224. DOI 10.1002/0471264180.os079.18.
- ↑ Yong-Chua Teo; Richard Hsung. Discussion Addendum for: Practical Synthesis of Novel Chiral Allenamides: (R)-4- Phenyl-3-(1,2-propadienyl)oxazolidin-2-one. Organic Syntheses. 2014, s. 12–26. DOI 10.15227/orgsyn.091.0012.
- ↑ H. Xiong; M. Tracey; T. Grebe; J. Mulder; R. Hsung. PRACTICAL SYNTHESIS OF NOVEL CHIRAL ALLENAMIDES: (R)-4-PHENYL-3-(1,2-PROPADIENYL)OXAZOLIDIN-2-ONE (2-Oxazolidinone, 4-phenyl-3-(1,2-propadienyl)–, (4R)–). Organic Syntheses. 2005, s. 147–156. DOI 10.15227/orgsyn.081.0147.
- ↑ William Donaldson. Synthesis of cyclopropane containing natural products. Tetrahedron. 2001-10-08, s. 8589. Dostupné online. DOI 10.1016/s0040-4020(01)00777-3.
- ↑ Synthesis of SUVN-911. Synfacts. 2020, s. 0626. ISSN 1861-1958. DOI 10.1055/s-0040-1707534.
Externí odkazy
 Obrázky, zvuky či videa k tématu Simmonsova–Smithova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Simmonsova–Smithova reakce na Wikimedia Commons - Simmonsova–Smithova reakce na organic-chemistry.org
Média použitá na této stránce
Autor: Gbowe, Licence: CC BY-SA 4.0
Cyclopropanation of allylic alcohols and isolated olefins
Autor: Ndurfee, Licence: CC BY-SA 4.0
The Charette Modification to the Simmons Smith Reaction
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Asymmetric Simmons Smith
Autor: Jdombroski, Licence: CC BY-SA 4.0
Simmons-Smith reaction used in the synthesis of gamma ketoesters
Autor: Gbowe, Licence: CC BY-SA 4.0
Furukawa-modified Simmons-Smith cyclopropanation reaction of a trimethylsilyloxy-substituted alkene
Autor: Gbowe, Licence: CC BY-SA 4.0
Simmons-Smith cyclopropanation reaction with a vinyl halide
Reaction mechanism of Simmons-Smith reaction.
Autor: Ndurfee, Licence: CC BY-SA 4.0
The Fukuwara Modification to the Simmons-Smith Reaction
Autor: Jdombroski, Licence: CC BY-SA 4.0
The natural product cilastatin, synthesized via a Simmons-Smith cyclopropanation.
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Simmons smith quaternary carbon rearrangement
Autor: Gbowe, Licence: CC BY-SA 4.0
Chemoselectivity demonstrated by a OTMS directing group
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Simmons-Smith cyclohexene to bicyclo-4.1.0-heptane illustration
Autor: Jdombroski, Licence: CC BY-SA 4.0
Simmons-Smith cyclopropanation in cilastatin synthesis
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Asymm Simmons Smith 2008
Autor: Jdombroski, Licence: CC BY-SA 4.0
Use of the Simmons-Smith reaction in synthesis of amido-spiro (2,2) pentanes
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Simmons Smith hydroxyl Effect.