Src
Src (čteno [sark]) je gen a stejnojmenný protein ze Src rodiny, který funguje jako nereceptorická tyrosinkináza (nejedná se tedy o tyrosinkinázový receptor). Jako první objevená tyrosinkináza vůbec[1][2] je znám pouze u mnohobuněčných živočichů.
Stavba
Src má velikost asi 60 kDa a na N-konci váže kyselinu myristovou.[1] Díky této mastné kyselině se váže k membráně, nicméně tak slabě, že účinkem fosforylace z ní snadno disociuje do cytosolu.[3]
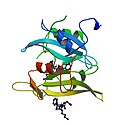
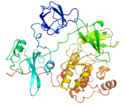
Skládá se z několika domén, které se od N-konce označují jako SH4, SH3, SH2 a SH1. Zkratky „SH“ znamenají „src homology“ a používají se k označení podobných (homologních) domén i v jiných proteinech, jež tyto domény obsahují. SH4 hraje roli v asociaci s membránou, SH3 umožňuje interakci s polyprolinovými oblastmi, SH2 se váže na fosforylovaný tyrosin, SH1 je samotnou katalytickou doménou umožňující tyrosinkinázovou funkci Src.[4]
C-src a v-src
Známy jsou dvě varianty Src proteinu:[1]
- c-src je protoonkogen, který v kinázové doméně obsahuje tyrosin, jehož fosforylací je src inhibován; hraje zřejmě významnou roli v buněčné signalizaci a diferenciaci, ale je velmi důkladně regulován.[3]
- v-src je onkogen nacházející se v genomu viru Rousova sarkomu (RSV); liší se od v-src C-terminálním koncem, daný tyrosin u něj chybí, a proto zřejmě nemůže být inhibován. Má schopnost například přetvářet fibroblasty na nádorové buňky.[2]
Kromě již zmíněného C-konce u v-src jsou si velmi strukturně podobné a rozdíly jsou spíše na úrovni několika aminokyselinových záměn.[5] Obě hrají významnou roli ve vzniku nádorového bujení.[2]
Význam
Nejvyšší exprese dosahuje Src gen v krevních destičkách a v mozku.[3] Role Src v buňkách obratlovců byla studována knockoutem myšího genu pro s-crc. Bylo zjištěno, že takoví mutantní jedinci mají problémy s prořezáváním zubů skrz dáseň a jejich lebka dosahuje nepřirozeného tvaru. Oba problémy zřejmě souvisí s poruchou funkce osteoklastů a následnou odlišnou hustotou kostí. Následky Src knockoutu však nejsou evidentně smrtelné a zdá se tedy, že roli src mohou poměrně dobře zastávat i jiní zástupci Src rodiny. Podobně na tom jsou výsledky výzkumu na D. melanogaster a C. elegans, v obou případech se mutantní jedinci s nefunkčním src genem těší poměrně dobrému zdraví a mutantní fenotyp obvykle není vůbec patrný.[2]
Reference
- ↑ a b c Oxford dictionary of biochemistry and molecular biology; revised edition. Příprava vydání R. Cammack et al. New York: Oxford university press, 2006. ISBN 0-19-852917-1.
- ↑ a b c d Jonathan A. Cooper. Src Family of Protein Tyrosine Kinases. In: Lennarz,W.J., Lane, M.D. Encyclopedia of Biological Chemistry , Four-Volume Set, 1-4. [s.l.]: [s.n.]
- ↑ a b c POLLARD, Thomas D; EARNSHAW, William C. Cell Biology. 2. vyd. [s.l.]: Saunders, 2007. ISBN 1416022554. S. 928.
- ↑ LAU, Lit-fui; HUGANIR, Richard L. Basic Neurochemistry: Molecular, Cellular and Medical Aspects. 6. vyd. Philadelphia: [s.n.], 1999. Dostupné online. ISBN 0-397-51820-X. Kapitola Protein Tyrosine Kinases.
- ↑ MARTIN, G. S. The hunting of the Src. Nat Rev Mol Cell Biol.. 2001, roč. 2, čís. 6, s. 467–75. Dostupné online. ISSN 1471-0072.
Média použitá na této stránce
Src kinase structure
Crystal structure of c-Src in its inactive state. The kinase domain (SH1 domain) is shown in red-green, the SH2-domain in cyan and the SH3 domain in blue. The shown structure which contains large parts of the c-Src protein is derived from the PDB structure 1FMK and initially described in Xu W. et al. (1997). Three-dimensional structure of the tyrosine kinase c-Src. Nature 385:595-602.