Stabilní karbeny

Stabilní karbeny jsou chemické sloučeniny patřící mezi karbeny, které vykazují určitou stabilitu. Jejich nejpočetnější skupinou jsou N-heterocyklické karbeny (NHC)[1] (někdy nazývané Arduengovy karbeny), jako jsou diaminokarbeny s obecným vzorcem (R2N)2C:, kde R jsou alkylové nebo arylové skupiny. Skupiny mohou být propojeny heterocyklickými karbeny, odvozenými například od imidazolu, imidazolinu, thiazolu nebo triazolu.
Karbeny jsou obvykle považovány za natolik reaktivní, že mohou být zkoumány pouze nepřímo; tento pohled se změnil s objevem stabilních karbenů – i když jsou stále velmi reaktivní, například vytvářejí dimery, tak mnoho z nich lze izolovat.
Tyto látky se mohou vyskytovat v singletových i tripletových stavech, přičemž singletové bývají většinou stabilnější; stabilitu však mohou také ovlivňovat sterické efekty vytvářené substituenty. Některé singletové karbeny jsou termodynamicky stabilní za nepřítomnosti vody a (většinou) kyslíku, dají se izolovat a skladovat, zatímco jiné se pomalu v řádu dnů rozkládají. Poločasy tripletových karbenů bývají na úrovni několika sekund, a tak mohou být pozorovány, ovšem ne izolovány.
Historie
V roce 1957 oznámil Ronald Breslow, že součástí katalytického cyklu vitaminu B1, při kterém vzniká furoin z furfuralu, je relativně stabilní karben, derivát thiazol-2-ylidenu.[2][3] V tomto cyklu thiazoliová skupina v molekule vitaminu vymění elektron (navázaný na atom C2 v cyklu) s furfuralovým zbytkem. V těžké vodě dochází k rychlé záměně protonu za deuteron,[4]
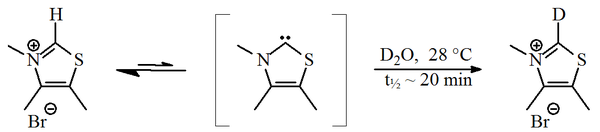
Reakce probíhá za účasti thiazol-2-ylidenu. V roce 2012 byl izolován meziprodukt této reakce, nazývaný „Breslowův meziprodukt“.[5][6]
Roku 1960 se při výzkumu, který vedl Hans-Werner Wanzlick, potvrdil vznik karbenů odvozených od dihydroimidazol-2-ylidenu při vakuové pyrolýze odpovídajících 2-trichlormethyl dihydroimidazolů.[7][8][9] Bylo zjištěno, že karben se vyskytuje v rovnováze se svým dimerem, derivátem tetraaminethenu. V roce 1964 však tým vedený Davidem M. Lemalem ukázal, že nedochází k disociaci dimeru;[10] k podobným závěrům dospěl také H. E. Winberg o rok později.[11] Další studie však ukázaly, že v některých případech k vytvoření rovnováhy dochází.[12][13]
Izolace stabilních karbenů
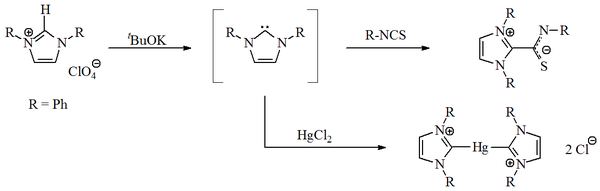
V roce 1970 skupina, kterou vedl H. W. Wanzlick, připravila imidazol-2-ylidenové karbeny deprotonací imidazoliových solí.[14] Wanzlick podobně jako Roald Hoffmann,[9][15] předpokládal, že tyto imidazolové karbeny by měly být díky aromaticitě stabilnější než jejich 4,5-dihydro analogy. Wanzlick ovšem nedokázal izolovat imidazol-2-ylidenové karbeny, ovšem získal jejich komplexy se rtutí a izothiokyanátovým aniontem.
V roce 1988 izoloval Guy Bertrand se svým týmem fosfinokarbeny, což jsou sloučeniny, které vytvářejí λ3-fosfinokarbenové i λ5-fosfaacetylenové rezonanční struktury.[16][17]

Tyto sloučeniny se účastní reakcí obvyklých u alkenů i těch, do kterých vstupují karbeny.
V roce 1991 byl připraven a izolován stabilní krystalický diaminokarben, který může mít karbenovou i ylidovou strukturu.[18] Příprava byla provedena deprotonací imidazoliumchloridu silnou zásadou:

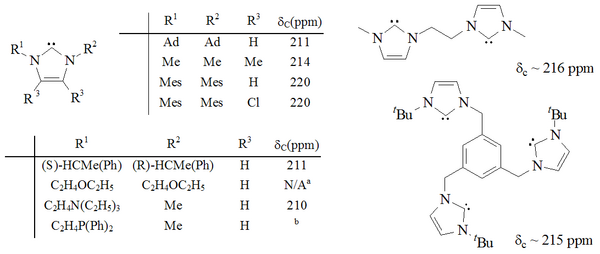
Tento karben, první ze skupiny karbenů s imidazol-2-ylidenovým jádrem, je při pokojové teplotě za nepřítomnosti kyslíku a vody neomezeně stabilní a taje při 240 až 241 °C, aniž by docházelo k rozkladu. Jeho další zajímavou vlastností je charakteristická rezonance v 13C NMR spektru při 211 ppm.[19] Pomocí rentgenové krystalografie bylo zjištěno, že vazba N-C v karbenovém cyklu je oproti imidazoliovému prekurzoru o něco delší, a tak zřejmě není násobná.[20]
První ylidový karben stabilní na vzduchu byl připraven roku 1995, šlo o chlorovaný derivát imidazol-2-ylidenu.[21]
V roce 2000 získal Guy Bernard několik fosfanylových stabilních karbenů, mimo jiné fosfanyl(trifluormethyl)karbeny stabilní v roztoku při -30 °C.[22] a rovněž poměrně stabilní (amino)(aryl)ové karbeny s jediným heteroatomem v sousedství karbenového atomu.[23][24]
Vliv různých jevů na stabilitu karbenů stabilizovaných heteroatomy

(externí prohlížeč)
Stabilita Arduengových karbenů byla původně přičítána objemným N-adamantylovým substituentům, které v důsledku sterických efektů brání dimerizaci, byly však rovněž připraveny stabilní karbeny, které místo nich mají methylové skupiny.[25] Imidazol-2-ylidenové karbeny jsou tedy termodynamicky stabilní.
Bylo také navrženo, že dvojná vazba mezi uhlíky 4 a 5 v imidazoliovém cyklu, která systému dodává aromaticitu, také významně přispívá k jeho stabilitě. Tato domněnka byla vyvrácena v roce 1995, kdy se podařilo vytvořit dihydroimidazol-2-ylidenový karben, který byl stabilní a přitom neobsahoval dvojnou vazbu.[26] Termodynamická stabilita této sloučeniny a vliv aromaticity na její stabilizaci jsou sporné.[27][28]

V roce 1996 byl připraven první acyklický stabilní karben,[29] čímž se ukázalo, že cyklický hlavní řetězec není k získání stabilního karbenu nutný. Molekuly acyklických karbenů mohou na rozdíl od cyklických rotovat; na základě měření energetické bariéry rotace lze určit povahu jejich vazeb a potvrdit jejich ylidovou strukturu. Podobně jako u cyklických karbenů zde při absenci sterických efektů dochází k dimerizaci.
Většina stabilních karbenů bývá stabilizována dvěma spojenými dusíkovými centry;výjimku tvoří aminothiokarbeny a aminooxykarbeny,[30][31] u kterých je karbenový atom mezi atomem dusíku a síry nebo kyslíku. Tyto karbeny na rozdíl od imidazolových podléhají dimerizaci.
U bis(diisopropylamino)cyklopropenylidenu, který je stabilní při pokojové teplotě, je karbenový atom propojen s dvěma atomy uhlíku v tříčlenném cyklu, který zachovává aromaticitu cyklopropenylidenového kruhu, což naznačuje, že přítomnost heteroatomů vedle karbenového atomu není ke stabilitě karbenu nutná.[32]
Druhy stabilních karbenů
Imidazol-2-ylideny
První izolované karbeny obsahovaly imidazolové kruhy, u kterých byly z uhlíků v pozicích 2 odstraněny atomy vodíku a ostatní vodíky byly nahrazeny různými funkčními skupinami. Imidazol-2-ylideny jsou dosud nejstabilnějšími známými a nejlépe prozkoumanými karbeny.
Bylo připraveno velké množství imidazol-2-ylidenů, mimo jiné ty, které mají na pozicích 1 a 3 alkylové, arylové,[25] alkyloxy, alkylamino, alkylfosfinové[33] nebo i chirální substituenty.

Substitucí kruhu v pozicích 4 a 5 atomy chloru byl připraven první známý stabilní karben.[21] Jeho stabilita je pravděpodobně způsobena odtahováním elektronů atomy chloru, čímž dochází ke snížení elektronové hustoty na uhlíku s volným elektronovým párem a vytvořením indukčního efektu po celém sigma řetězci.
Byly též získány molekuly obsahující dvě nebo tři imidazol-2-ylidenové skupiny.[34][35]
Imidazolové karbeny jsou termodynamicky stabilní a lze je identifikovat pomocí 13C NMR posunu mezi 210 a 230 ppm. Úhly vazeb C-N mívají hodnoty od 101 do 102°.
Triazol-5-ylideny
Další skupinou jsou karbeny odvozené od 1,2,4-triazolu, s nezaplněnými orbitaly uhlíku v pozici 5. Triazol-5-ylideny poprvé připravil D. Enders se svým týmem[36] vakuovou pyrolýzou 2-methoxytriazolů, vedoucí k odštěpení methanolu. Bylo popsáno jen málo látek z této skupiny; trifenylované však lze zakoupit.
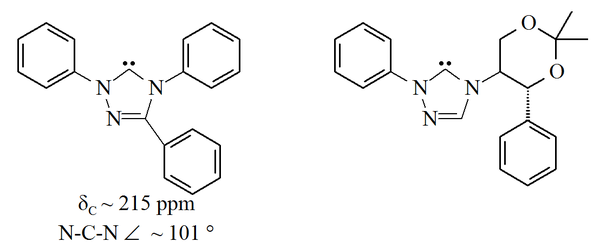
Triazolové karbeny jsou termodynamicky stabilní a mají 13C NMR posun od 210 do 230 ppm. Úhly vazeb C-N bývají kolem 101°. 5-methoxytriazolové prekurzory těchto karbenů se připravují reakcí triazoliových solí s methoxidem sodným, který reaguje s nukleofilem;[36] to naznačuje, že jsou méně aromatické než imidazolové karbeny, protože imidazoliové sloučeniny s nukleofily kvůli ztrátě aromaticity nereagují.
Ostatní diaminokarbeny
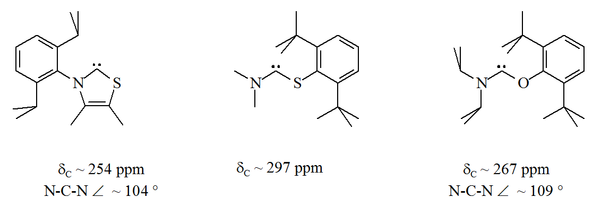
Dvě výše uvedené skupiny jsou zvláštními případy sloučenin s karbenovým uhlíkem napojeným na dva atomy dusíku. Mnoho těchto sloučenin, diaminokarbenů, připravil poprvé Roger Alder se svými spolupracovníky. V některých sloučeninách je vazba N-C-N součástí pětičlenného nebo šestičlenného nearomatického cyklu;[26][27][37] může jít i o bicyklické látky. V jiných molekulách jsou sousední dusíkové atomy propojeny pouze karbenovými atomy a mohou, ovšem nemusí, tvořit samostatné cykly.[29][38][39]

Na rozdíl od aromatických imidazol-2-ylidenů a triazol-5-ylidenů tyto karbeny nejsou termodynamicky stabilní, což se u některých z nich projevuje dimerizací.[27][38] Katalyzátory dimerizace jsou kyseliny.[28]
Diaminokarbeny mívají 13C NMR posun u karbenového uhlíku od 230 do 270 ppm. Úhel vazby N-C-N je přibližně 106°, u acylových karbenů 121°; v obou případech jde o větší úhly než u imidazol-2-ylidenů.
Heteroaminokarbeny
Existuje několik stabilních karbenů, u kterých je jeden z atomů dusíku navázaných na karbenový uhlík nahrazen jiným heteroatomem, jako je kyslík, síra nebo fosfor.[16][17][30][31]
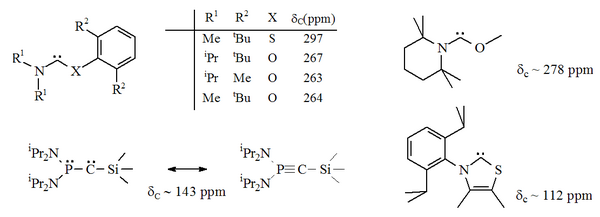
Nahrazením jednoho z dusíků imidazolového kruhu atomem síry lze odvodit aromatické heterocyklické sloučeniny nazývané thiazoly. Bylo připraveno[40] a pomocí rentgenové krystalografie prozkoumáno také několik thiazolových karbenů.[30] Je také známo několik karbenů s atomy O, S a P vedle karbenového uhlíku, jako jsou thio- a oxyiminiové karbeny.[31]
Protože jsou kyslík a síra dvojvazné, tak je sterická ochrana karbenového centra omezená, obzvláště, pokud je jednotka N-C-X součástí cyklu.
Karbeny formálně odvozené od imidazol-2-ylidenů nahrazením obou α-dusíků kyslíkem, sírou či jinými chalkogeny jsou pravděpodobně nestabilní a předpokládá se u nich rozklad na alkyny (R1C≡CR2) a chalkogenidy uhlíku (X1=C=X2).
Neaminové karbeny
Reakcí sirouhlíku (CS2) s deriváty ethynu s nízkou elektronovou hustotou vznikají 1,3-dithiolithiové karbeny, které se následně dimerizují na deriváty tetrathiafulvalenu. U některých podobných karbenů by mohla probíhat odpovídající zpětná reakce.[41][42]
Bertrandovy karbeny
V Bertrandových karbenech je nenasycený atom uhlíku vázán na fosfor a křemík.[43] Tyto sloučeniny mají ovšem některé vlastnosti spíše odpovídající alkynům.[17]
Ostatní nukleofilní karbeny
Byl připraven karben, který má strukturu podobnou borazinu, u kterého je jeden atom boru nahrazen methylenovou skupinou,[44] vzniklá sloučenina má šestielektronovou rovinnou molekulu.
Cyklopropenylideny
Další skupina karbenů se skládá z cyklopropenylidenového jádra, tříčlenného uhlíkatého cyklu s dvojnou vazbou mezi dvěma atomy sousedícími s karbenovým atomem. Příkladem je bis(diisopropylamino)cyklopropenyliden.[32]
Tripletové karbeny
V roce 2001 připravil Hideo Tomioka poměrně stabilní tripletový karben (bis(9-anthryl)karben) rozkládající se s poločasem 19 minut; jeho stabilizace je způsobena delokalizací elektronů.[45][46]

V roce 2006 byl popsán tripletový karben s poločasem 40 minut.[47] Tento karben byl připraven fotochemickým rozkladem diazomethanu zářením o vlnové délce 300 nm v benzenu za vývoje dusíku.
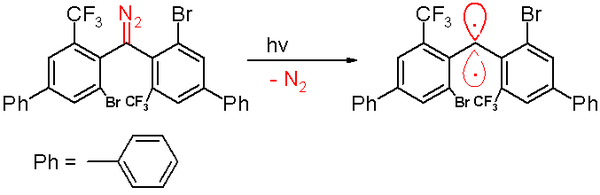
Tento karben reaguje s kyslíkem za vzniku benzofenonu. Jeho zachycením v cyklohexa-1,4-dienu se tvoří derivát difenylmethanu. Podobně jako u ostatních stabilních karbenů se v jeho molekulách nacházejí objemné substituenty, zde jde o atomy bromu a trifluormethylové skupiny na fenylových jádrech; tyto substituenty stíní karbenový uhlík a zabraňují dimerizaci na 1,1,2,2-tetra(fenyl)alken. Na základě metod výpočetní chemie bylo zjištěno, že délka vazby u dvojvazného uhlíku je 138 pm a vazebný úhel má hodnotu 158,8°. Odchylka rovin fenylových skupin je 85,7°.
Mezoiontové karbeny
Mezoiontové karbeny jsou podobné N-heterocyklickým karbenům, pouze jejich rezonanční struktury nelze znázornit bez přidání dalších nábojů. Také bývají nazývány N-heterocyklickými karbenyl. Lze připravit mnoho takových sloučenin, které jsou většinou stabilní.
Příprava
NHC bývají silně zásadité (pKa konjugované kyseliny imidazol-2-ylidenu je přibližně 24)[48] a reagují s kyslíkem. Jejich příprava se tak provádí za nepřístupu vzduchu a nepřítomnosti, byť jen mírně, kyselých sloučenin. Imidazoliové soli jsou odolné vůči nukleofilním adicím, ovšem ostatní nearomatické soli (například soli formamidinia) takto odolné nejsou.[49]
V těchto případech je nutné se vyhnout silným nukleofilům, ať už vznikajícím při reakcích nebo přítomných jako nečistoty v reaktantech (jako bývá hydroxid lithný v butyllithiu).
Bylo vyvinuto několik způsobů přípravy stabilních karbenů, ty jsou uvedeny níže:
Deprotonace
Deprotonací prekurzorových solí silnými zásadami lze připravit téměř všechny stabilní karbeny:
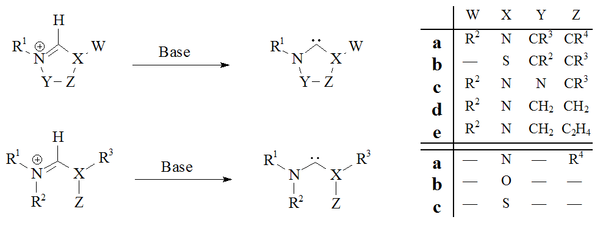
Imidazol-2-ylideny a dihydroimidazol-2-ylideny se získávají deprotonací příslušných imidazoliových a dihydroimidazoliových solí. Acyklické[29][38] a tetrahydropyrimidinylové[37] karbeny se připravují pomocí silných homogenních zásad.
Při použití různých zásad za různých podmínek se účinnost reakce liší; závisí především na vlastnostech prekurzoru. Nevýhodou deprotonační přípravy je nutnost oddělit karbeny od kovových iontů používaných při reakcích.
Použití hydridů kovů
Dalo by se předpokládat, že hydrid sodný nebo draselný je pro přípravu karbenů nejvhodnější zásadou. Hydrid by měl nevratně reagovat za odštěpení protonu a tvorby požadovaného karbenu a také anorganických vedlejších produktů, které lze snadno odfiltrovat. Tato reakce však většinou probíhá pomalu a je nutné do reakční směsi přidat dimethylsulfoxid nebo terc-butanol.[18][25] Z použitých reaktantů se potom tvoří rozpustné katalyzátory, které reakci urychlují díky tvorbě terc-butoxidů nebo dimsylových solí. Nearomatické soli mohou reagovat s hydroxidovými anionty přítomnými jako nečistoty v hydridu.[25]
Použití alkyllithných sloučenin
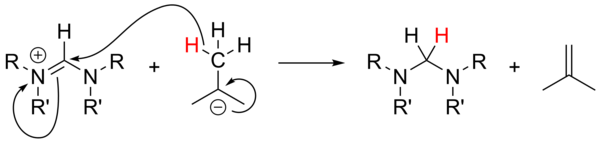
Použití alkyllithných sloučenin jako zásad[18] není podrobně prozkoumáno. S nearomatrickými solemi n-butyllithium a fenyllithium reagují jako nukleofily, zatímco t-butyllithum může fungovat jako zdroj hydridových iontů, který redukuje soli za tvorby isobutenu:
Amidové zásady
Lithné amidy, jako je diisopropylamid (LDA) a (tetramethylpiperidid (LiTMP))[29][38] jsou dobrými činidly pro deprotonaci všech solí, a to za předpokladu, že v butyllithiu použitém na přípravu amidu není přítomen ve větších množstvích hydroxid lithný; ke stanovení jeho koncentrace lze použít odměrnou analýzu. Deprotonace prekurzorových solí hexamethyldisilazidy kovů dobře probíhá u téměř všech solí, výjimku tvoří formamidiniové soli, které fungují jako nukleofily a vytvářejí triaminomethanové adukty.
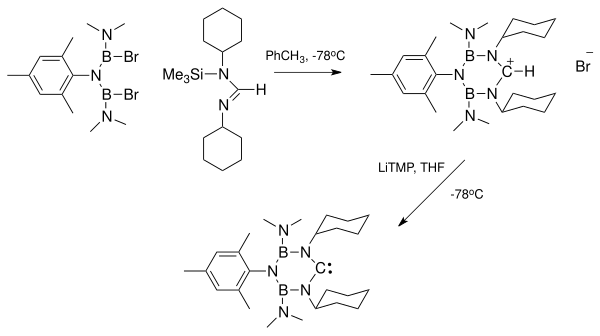
Příprava karbenů neobsahujících kovy

Příprava stabilních karbenů neobsahujících ionty kovů byla často zkoumána za účelem přípravy NHC bez nutnosti jejich oddělování od kovů. Oddělování karbenu z komplexu s kovem je obtížné kvůli tomu, že tyto komplexy bývají stabilní a tak se upřednostňuje příprava karbenů bez těchto kovů. V některých případech kovy spíše napomáhají dimerizaci karbenu než jeho stabilizaci.
Vpravo je zobrazena struktura bis(trimethylsilyl)aminu draselného zjištěná pomocí rentgenové krystalografie; tato látka se získává reakcí přebytku bis(trimethylsilyl)amidu draselného (KHMDS), použitého jako silná zásada, k deprotonaci formamidiniové soli. Odstraněním lithných iontů vzniklých použitím zásad jako je diisopropylamid lithný může být obtížné. Draselné a sodné soli vznikající jako vedlejší produkty se mohou vysrážet z roztoku a následně být odfiltrovány. Lithné ionty lze odstranit jejich navázáním na látky jako jsou kryptandy.
Dechalkogenace
Dalším způsobem přípravy karbenů je desulfurace thiomočoviny tetrahydrofuranovým roztokem draslíku.[27][50] Tuto reakci významně ovlivňuje skutečnost, že vedlejší produkt, sulfid draselný, se v použitém rozpouštědle nerozpouští. Nutnost použití vyšších teplot znamená, že tento postup není možné použít na přípravu nestabilních dimerizujících karbenů. Byla také popsána deoxygenace močoviny fluorenovým karbenem za tvorby tetramethyldiaminokarbenu a fluorenonu:[51]
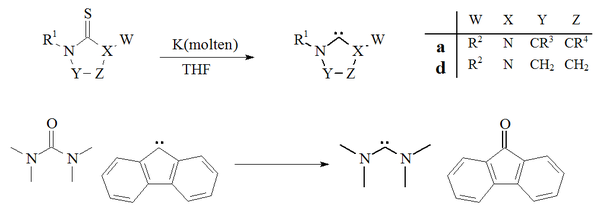
Desulfurizace derivátů thiomočoviny kapalným draslíkem na imidazol-2-ylideny nebo diaminokarbeny se příliš často neprovádí; je ovšem možné tímto způsobem získat dihydroimidazolové karbeny.[27]
Vakuová pyrolýza
Vakuovou pyrolýzou, za odstraňování neutrálních těkavých vedlejších produktů (CH3OH, CHCl3) lze připravit dihydroimidazolové a triazolové karbeny:
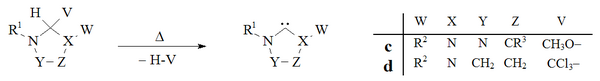
Odstraňování vedlejších produktů vakuovou pyrolýzou aduktů d použil Hans-Werner Wanzlick[8] při pokusech připravit dihydroimidazol-2-ylideny; tato metoda se však téměř nepoužívá. V Endersově laboratoři[36] byla využita vakuová pyrolýza aduktu c na přípravu triazolium-5-ylidenu c.
Využití bis(trimethylsilyl)rtuti
Bis(trimethylsilyl)rtuť (CH3)3Si-Hg-Si(CH3)3 reaguje s chloriminiovými a chloramidiniovými solemi za tvorby karbenů aelementární rtuti,[52] například:
(CH3)3Si-Hg-Si(CH3)3 + R2N=C(Cl)-NR2+ Cl− → R2N-C:-NR2 + Hg(l) + (CH3)3Si-Cl
Fotolýza
Tripletové karbeny je možné připravit fotolýzou derivátů diazomethanu, pomocí záření o vlnové délce 300 nm. za uvolnění kyslíku; reakce probíhá v benzenu.
Přečištění
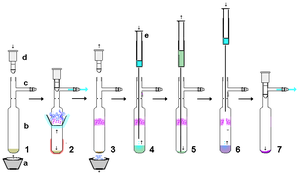
Stabilní karbeny jsou značně reaktivní, a tak je nutné s nimi nakládat za nepřístupu vzduchu. Používají se přitom suché a nekyselé materiály. Stabilní karben získaný z hydridu draselného lze přečistit filtrací pomocí suché křemeliny, čímž se oddělí zbytky hydridu a vzniklých solí. Suspenze obsahující karben se usadí a roztok supernatantu projde suchou membránou. Stabilní karbeny jsou snadno rozpustné v nepolárních rozpouštědlech, například hexanu, a tak je jejich rekrystalizace obvykle obtížná kvůli nedostupnosti vhodného nepolárního nekyselého rozpouštědla. Sublimací za nepřístupu vzduchu, jak je znázorněno vpravo, lze karbeny účinně přečistit, ovšem proces probíhá obvykle při teplotách pod 60 °C a za velmi nízkých tlaků, a to v důsledku těkavosti karbenů a také kvůli tomu, že se při vyšších teplotách rozkládají. Sublimací je navíc často možné získat jednotlivé krystaly použitelné při analýze rentgenovou krystalografií. Sublimaci ovšem v některých případech brání tvorba komplexů s ionty kovů, jako je lithium.
Chemické vlastnosti
Zásaditost a nukleofilita
Imidazol-2-ylideny jsou silné zásady, pKa konjugovaných kyselin v dimethylsulfoxidových roztocích bývá kolem 24.[48]

Ukázalo se ovšem, že diaminokarbeny deprotonují DMSO, čímž vznikají příslušné amidiniové soli:
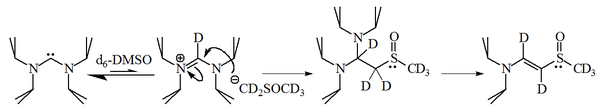
Reakcí imidazol-2-ylidenu s 1-bromhexanem vzniká z 90 % 2-substituovaný a z 10 % alken, což ukazuje na nukleofilitu karbenů.
pKa triazoliových solí bývá 16,5 až 17,8,[53] jejich kyselost je tak asi tisíckrát vyšší než u imidazoliových solí.[54]
Dimerizace
Původně se předpokládalo, že stabilní karbeny se dimerizují za vzniku Wanzlickovy rovnováhy. Imidazol-2-ylideny a triazol-5-ylideny jsou ovšem vůči dimerizaci odolné a lze je uchovávat v roztocích, za nepřítomnosti vody a vzduchu, i několik let; jejich stabilitu nejspíše vyvolává aromaticita. Imidazol-2-ylideny jsou dokonce tak stabilní, že se dimerizují jen za značně extrémních podmínek.
T. A. Taton a P. Chen[55] připravili diimidazol-2-ylideny deprotonací příslušných diimidazoliových solí. Pouze dimerizací diimidazoliových solí s kratšími methylenovými můstky (-CH2-) vznikaly dimery:

Pokud by tento dimer měl dikarbenovou strukturu, tak by se volné elektronové páry na karbenových uhlících k sobě značně přiblížily, což by vedlo k silnému elektrostatickému odpuzování a výrazné destabilizaci molekuly. Dimerizace karbenových skupin tomu však brání.
Heteroaminokarbeny (například R2N-C:-OR nebo R2N-C:-SR) a nearomatické karbeny, jako jsou diaminokarbeny (například R2N-C:-NR2) podléhají dimerizaci,[56] i když, pravděpodobně kvůli vysoké aktivační energii dimerizace singletového stavu, pomalu:
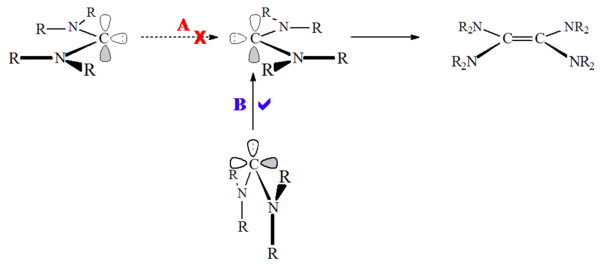
U diaminokarbenů ke skutečné dimerizaci nedochází, místo toho se dimery tvoří přes formamidiniové soli,[28] což jsou protonované prekurzory; reakce tedy bývá katalyzována kyselinami. K reakci dochází díky tomu, že na rozdíl od imidazoliových karbenů zde nedochází ke ztrátě aromaticity při protonaci karbenu.
Reaktivita
Chemie stabilních karbenů není dosud dobře prozkoumaná, byla však popsána řada reakcí triazol-5-ylidenů.[36][57][58] Tyto reakce lze považovat za modelové pro další karbeny.

| a | 3,6-difenyl-1,2,4,5-tetrazin, toluen | 92 % | e | 2 ekvivalenty, PhNCO, toluen, reflux | 92 % | |
|---|---|---|---|---|---|---|
| b | RXH, RT | 95–97 % | f | CS2, toluen nebo PhNCS, THF, RT | 71–90 % | |
| c | O2, S8 nebo Se, toluen, reflux | 54–68 % | g | Maleimid, THF, RT | 47–84 % | |
| d | R1CH=CHR2, THF, RT | 25–68 % | h | Dimethylacetylendikarboxylát, THF, reflux | 21 % |
Karbeny se chovají jako nukleofily (e a f), účastní se inserčních (b), adičních (c), [2+1] cykloadičních (d, g a h), [4+1] cykloadičních (a) i deprotonačních reakcí. Při inserčních reakcích (b) pravděpodobně dohází k deprotonaci za vzniku nukleofilu (−XR), který následně reaguje se vzniklou solí.
Popsané stabilní isothiazolové karbeny (2) odvozené od chlorečnanu isothiazolia[59] byly prozkoumány,[60] přičemž se podařilo izolovat pouze 2-imino-2H-thiet (4). Meziprodukt (3) vzniká při přesmykové reakci. Tento karben není považován za stabilní.[61]

Komplexace karbenů
Imidazol-2-ylideny a triazol-5-ylideny (a v menší míře také diaminokarbeny) mohou vytvářet komplexy s alkalickými a přechodnými kovy i s lanthanoidy a aktinoidy. Tyto komplexy lze identifikovat pomocí rentgenové krystalografie.[37][62][63] Stabilní karbeny mají podobné koordinační vlastnosti jako fosfiny. Jedná se o dobré σ-donory, i přes volný elektronový pár na karbenovém uhlíku, ovšem špatné π-akceptory kvůli přenosu ligandů z dusíkového atomu sousedícího s karbenovým centrem, a tak mohou tvořit komplexy i s kovy majícími nízkou elektronovou hustotu. D. Enders[64] a Wolfgang A. Hermann[65][66] ukázali, že tyto karbeny mohou nahradit fosfinové ligandy v některých katalytických cyklech. Bylo vytvořeno několik katalytických systémů obsahujících imidazolové a triazolové karbeny jako ligandy.[62][64][65][66] R. H. Grubbs[67] popsal nahrazení fosfinového ligandu (PCy3) imidazol-2-ylidenem u katalyzátoru metateze olefinů RuCl2(PCy3)2CHPh. Molekuly obsahující dvě či tři karbenové jednotky lze použít jako bidentátní nebo tridentátní ligandy.[34][35]
Karbeny v organokovové chemii a katalýze
Karbeny lze stabilizovat ve formě komplexů s přechodnými kovy. Tyto komplexy se dělí na dvě skupiny:
- Fischerovy karbeny, obsahující skupiny odtahující elektrony (například karbonyl)
- Schrockovy karbeny, které obsahují skupiny dodávající elektrony; reakce těchto karbenů jsou značně odlišné od reakcí klasických organických karbenů.
Tripletové karbeny
Stabilní tripletové karbeny reagují podobně jako nestabilní karbeny.
Fyzikální vlastnosti
Dosud známé stabilní karbeny jsou bezbarvé pevné látky s nízkými teplotami tání. Za nízkých teplot a tlaků sublimují.
K užitečným vlastnostem patří charakteristický posun u karbenového uhlíku v 13C-NMR spektru, obvykle mezi 200 a 300 ppm; například u vlevo zobrazeného cyklického diaminokarbenu jde o 238 ppm.
Při vzniku komplexu s kovem se karbenová rezonance 13C většinou, v závislosti na Lewisovské kyselosti, zvýrazní. Na základě těchto vlastností byla vyvinuta nová metoda určení síly ligandu pomocí 13C NMR analýzy pomocí trans-palladnatých komplexů karbenů. Použitím N-heterocyklických karbenů značkovaných izotopem 13C je také možné zkoumat smíšené karbeno-fosfinové komplexy, u kterých probíhá trans-cis-isomerizace[68]
Použití

NHC se používají jako ligandy v organokovové chemii, jedním z jejich využití je příprava rutheniových katalyzátorů nazývaných Grubbsovy katalyzátory.[69][70][71]
Komplexy NHC s kovy, obzvláště Ag(I)-NHC komplexy, byly zkoumány díky možným biologickým využitím.[72]
Reference
V tomto článku byl použit překlad textu z článku Persistent carbene na anglické Wikipedii.
- ↑ M. N. Hopkinson; C. Richter; M. Schedler; F. Glorius. An Overview of N-Heterocyclic Carbenes. Nature. 2014, s. 485–496. DOI 10.1038/nature13384. PMID 24965649. Bibcode 2014Natur.510..485H.
- ↑ Ronald Breslow. Mechanism of Thiamine Action: Participation of a Thiazolium Zwitterion. Chemistry and Industry. 1957, s. 893.
- ↑ Ronald Breslow. On the Mechanism of Thiamine Action. IV.1 Evidence from Studies on Model Systems. Journal of the American Chemical Society. 1958, s. 3719–3726. DOI 10.1021/ja01547a064.
- ↑ Ronald Breslow. Rapid Deuterium Exchange in Thiazolium Salts. Journal of the American Chemical Society. 1957, s. 1762–1763. DOI 10.1021/ja01564a064.
- ↑ A. Berkessel; S. Elfert; V. R. Yatham; J.-M. Neudörfl; N. E. Schlörer; J. H. Teles. 'Umpolung by N-Heterocyclic Carbenes: Generation and Reactivity of the Elusive 2,2-Diamino Enols (Breslow Intermediates). Angewandte Chemie International Edition. 2012, s. 12 370 – 12 374. DOI 10.1002/anie.201205878. PMID 23081675.
- ↑ Chemists Approach Elusive Breslow Intermediate Carmen Drahl
- ↑ Hans-Werner Wanzlick; E. Schikora. Ein neuer Zugang zur Carben-Chemie. Angewandte Chemie. 1960, s. 494. DOI 10.1002/ange.19600721409.
- ↑ a b Hans-Werner Wanzlick; E. Schikora. Ein nucleophiles Carben. Chemische Berichte. 1960, s. 2389–2393. DOI 10.1002/cber.19610940905.
- ↑ a b Hans-Werner Wanzlick. Aspects of Nucleophilic Carbene Chemistry. Angewandte Chemie International Edition in English. 1962, s. 75–80. DOI 10.1002/anie.196200751.
- ↑ D. M. Lemal; R. A. Lovald; K. I. Kawano. Tetraaminoethylenes. The Question of Dissociation. Journal of the American Chemical Society. 1964, s. 2518–2519. DOI 10.1021/ja01066a044.
- ↑ H. E. Winberg; J. E. Carnahan; D. D. Coffman. Tetraaminoethylenes. Journal of the American Chemical Society. 1965, s. 2055–2056. DOI 10.1021/ja01087a040.
- ↑ M. K. Denk; K. Hatano; M. Ma. Nucleophilic Carbenes and the Wanzlick Equilibrium A Reinvestigation. Tetrahedron Letters. 1999, s. 2057–2060. DOI 10.1016/S0040-4039(99)00164-1.
- ↑ P. W. Böhm Volker; A. Herrmann Wolfgang. The Wanzlick Equilibrium. Angewandte Chemie. 2000, s. 4036–4038. DOI 10.1002/1521-3773(20001117)39:22<4036::AID-ANIE4036>3.0.CO;2-L.
- ↑ H. W. Wanzlick; YES. Chemie nucleophiler Carbene, XVIII1) 1.3.4.5-Tetraphenyl-imidazoliumperchlorat. Liebigs Annalen. 1970, s. 176–179. DOI 10.1002/jlac.19707310121. (anglicky)
- ↑ R. Gleiter; R. HOFFMANN. Stabilizing a singlet methylene. J. Am. Chem. Soc.. 1968, s. 5457–5460. DOI 10.1021/ja01022a023. (anglicky)
- ↑ a b A. Igau; H. GRUTZMACHER; A. BACEIREDO; G. BERTRAND. Analogous α,α'-bis-carbenoid, triply bonded species: synthesis of a stable λ3-phosphino carbene-λ3-phosphaacetylene. J. Am. Chem. Soc.. 1988, s. 6463–6466. DOI 10.1021/ja00227a028. (anglicky)
- ↑ a b c G. Bertrand; R. REED. λ3-Phosphinocarbenes λ5-phosphaacetylenes. Coordination Chemistry Reviews. 1994, s. 323–355. DOI 10.1016/0010-8545(94)03005-B. (anglicky)
- ↑ a b c A. J. Arduengo, R. L. Harlow and M. Kline. A stable crystalline carbene. J. Am. Chem. Soc.. 1991, s. 361–363. DOI 10.1021/ja00001a054. (anglicky)
- ↑ TAPU, Daniela; DIXON, David A.; ROE, Christopher. 13C NMR Spectroscopy of "Arduengo-type" Carbenes and Their Derivatives. Chemical Reviews. 12 August 2009, s. 3385–3407. DOI 10.1021/cr800521g. PMID 19281270. (anglicky)
- ↑ ARDUENGO, Anthony J.; HARLOW, Richard L.; KLINE, Michael. A stable crystalline carbene. Journal of the American Chemical Society. January 1991, s. 361–363. DOI 10.1021/ja00001a054. (anglicky)
- ↑ a b A. J. Arduengo; F. DAVIDSON; H. V. R. DIAS; J. R. GOERLICH; D. KHASNIS; W. J. MARSHALL; T. K. PRAKASHA. An Air Stable Carbene and Mixed Carbene "Dimers". J. Am. Chem. Soc.. 1997, s. 12742–12749. DOI 10.1021/ja973241o. (anglicky)
- ↑ Christophe Buron; HEINZ GORNITZKA; VADIM ROMANENKO; GUY BERTRAND. Stable Versions of Transient Push-Pull Carbenes: Extending Lifetimes from Nanoseconds to Weeks. Science. 2000, s. 834–836. DOI 10.1126/science.288.5467.834. PMID 10796999. Bibcode 2000Sci...288..834B. (anglicky)
- ↑ SOLÉ, Stéphane; GORNITZKA, Heinz; SCHOELLER, Wolfgang W.; BOURISSOU, Didier; BERTRAND, Guy. (Amino)(Aryl)Carbenes: Stable Singlet Carbenes Featuring a Spectator Substituent. Science. 2001, s. 1901–1903. DOI 10.1126/science.292.5523.1901. PMID 11397943. Bibcode 2001Sci...292.1901S. (anglicky)
- ↑ Lai Chun-Liang; GUO WEN-HSIN; LEE MING-TSUNG; HU CHING-HAN. Ligand properties of N-heterocyclic and Bertrand carbenes: A density functional study. Journal of Organometallic Chemistry. 2005, s. 5867–5875. DOI 10.1016/j.jorganchem.2005.07.058. (anglicky)
- ↑ a b c d A. J. Arduengo; H. V. R. DIAS; R. L. HARLOW; M. KLINE. Electronic stabilization of nucleophilic carbenes. J. Am. Chem. Soc.. 1992, s. 5530–5534. DOI 10.1021/ja00040a007. (anglicky)
- ↑ a b J. Arduengo; J. R. GOERLICH; W. J. MARSHALL. A stable diaminocarbene. J. Am. Chem. Soc.. 1995, s. 11027–11028. DOI 10.1021/ja00149a034. (anglicky)
- ↑ a b c d e M. K. Denk; A. THADANI; K. HATANO; A. J. LOUGH. Steric Stabilization of Nucleophilic Carbenes. Angew. Chem. Int. Ed. Engl.. 1997, s. 2607–2609. DOI 10.1002/anie.199726071. (anglicky)
- ↑ a b c ALDER, RW; CHAKER, L; PAOLINI, FP. Bis(diethylamino)carbene and the mechanism of dimerisation for simple diaminocarbenes. Chemical Communications (Cambridge, England). 2004, s. 2172–3. DOI 10.1039/b409112d. PMID 15467857. (anglicky)
- ↑ a b c d R. W. Alder; P. R. ALLEN; M. MURRAY; A. G. ORPEN. Bis(diisopropylamino)carbene. Angew. Chem. Int. Ed. Engl.. 1996, s. 1121–1123. DOI 10.1002/anie.199611211. (anglicky)
- ↑ a b c A. J. Arduengo, J. R. Goerlich and W. J. Marshall. A Stable Thiazol-2-ylidene and Its Dimer. Liebigs Annalen. 1997, s. 365–374. DOI 10.1002/jlac.199719970213. (anglicky)
- ↑ a b c R. W. Alder; C. P. BUTTS; A. G. ORPEN. Stable Aminooxy- and Aminothiocarbenes. J. Am. Chem. Soc.. 1998, s. 11526–11527. DOI 10.1021/ja9819312. (anglicky)
- ↑ a b LAVALLO, Vincent; CANAC, Yves; DONNADIEU, Bruno; SCHOELLER, Wolfgang W.; BERTRAND, Guy. Cyclopropenylidenes: From Interstellar Space to an Isolated Derivative in the Laboratory. Science. 2006, s. 722–724. DOI 10.1126/science.1126675. PMID 16614171. Bibcode 2006Sci...312..722L. (anglicky)
- ↑ W. A. Herrmann; C. KOCHER; L. J. GOOSSEN; G. R. J. ARTUS. Heterocyclic Carbenes: A High-Yielding Synthesis of Novel, Functionalized N-Heterocyclic Carbenes in Liquid Ammonia. Chem. Eur. J.. 1996, s. 1627–1636. DOI 10.1002/chem.19960021222. (anglicky)
- ↑ a b W. A. Herrmann; M. ELISON; J. FISCHER; C. KOCHER; G. R. J. ARTUS. N-Heterocyclic Carbenes: Generation under Mild Conditions and Formation of Group 8–10 Transition Metal Complexes Relevant to Catalysis. Chem. Eur. J.. 1996, s. 772–780. DOI 10.1002/chem.19960020708. (anglicky)
- ↑ a b H. V. R. Dias; W. C. JIN. A stable tridentate carbene ligand. Tetrahedron Letters. 1994, s. 1365–1366. DOI 10.1016/S0040-4039(00)76219-8. (anglicky)
- ↑ a b c d D. Enders; K. BREUER; G. RAABE; J. RUNSINK; J. H. TELES; J. P. MELDER; K. EBEL. Preparation, Structure, and Reactivity of 1,3,4-Triphenyl-4,5-dihydro-1H-1,2,4-triazol-5-ylidene, a New Stable Carbene. Angew. Chem. Int. Ed. Engl.. 1995, s. 1021–1023. DOI 10.1002/anie.199510211. (anglicky)
- ↑ a b c R. W. Alder; M. E. BLAKE; C. BORTOLOTTI; S. BUFFALI; C. P. BUTTS; E. LINEHAM; J. M. OLIVA. Complexation of stable carbenes with alkali metals. Chemical Communications. 1999, s. 241–242. DOI 10.1039/a808951e. (anglicky)
- ↑ a b c d R. W. Alder; M. E. BLAKE. Bis(N-piperidyl)carbene and its slow dimerisation to tetrakis(N-piperidyl)ethene. Chem. Commun.. 1997, s. 1513–1514. DOI 10.1039/a703610h. (anglicky)
- ↑ R. W. Alder; M. E. BLAKE; J. M. OLIVA. Diaminocarbenes; Calculation of Barriers to Rotation about Ccarbene-N Bonds, Barriers to Dimerization, Proton Affinities, and 13C NMR Shifts. J. Phys. Chem. A. 1999, s. 11200–11211. DOI 10.1021/jp9934228. Bibcode 1999JPCA..10311200A. (anglicky)
- ↑ R. Breslow. Rapid Deuterium Exchange in Thiazolium Salts. J. Am. Chem. Soc.. 1957, s. 1762–1763. DOI 10.1021/ja01564a064. (anglicky)
- ↑ H. D. Haztzler. Nucleophilic 1,3-dithiolium carbenes. J. Am. Chem. Soc.. 1970, s. 1412–1413. DOI 10.1021/ja00708a058. (anglicky)
- ↑ H. D. Hartzler. 1,3-Dithiolium carbenes from acetylenes and carbon disulfide. J. Am. Chem. Soc.. 1972, s. 4379–4387. DOI 10.1021/ja00794a039. (anglicky)
- ↑ G. Bertrand; A. IGAU; A. BACEIREDO; G. TRINQUIER. [Bis(diisopropylamino)phosphino]trimethylsilylcarbene: A Stable Nucleophilic Carbene. Angew. Chem. Int. Ed. Engl.. 1989, s. 621–622. DOI 10.1002/anie.198906211. (anglicky)
- ↑ PRÄSANG, C.; DONNADIEU, B.; BERTRAND, G. Stable Planar Six-π-Electron Six-Membered N-Heterocyclic Carbenes with Tunable Electronic Properties. J. Am. Chem. Soc.. 2005, s. 10182–10183. DOI 10.1021/ja052987g. PMID 16028925. (anglicky)
- ↑ TOMIOKA, H; IWAMOTO, E; ITAKURA, H; HIRAI, K. Generation and characterization of a fairly stable triplet carbene. Nature. 2001, s. 626–8. DOI 10.1038/35088038. PMID 11493917. S2CID 4373216. Bibcode 2001Natur.412..626T. (anglicky)
- ↑ Michael Freemantle. Triplet Carbene has Long Life. Chemical & Engineering News. 2001-08-13, s. 11. Dostupné online. DOI 10.1021/cen-v079n033.p011a. (anglicky)
- ↑ ITOH, T; NAKATA, Y; HIRAI, K; TOMIOKA, H. Triplet Diphenylcarbenes Protected by Trifluoromethyl and Bromine Groups. A Triplet Carbene Surviving a Day in Solution at Room Temperature. J. Am. Chem. Soc.. 2006, s. 957–967. DOI 10.1021/ja056575j. PMID 16417387. (anglicky)
- ↑ a b R. W. Alder; P. R. ALLEN; S. J. WILLIAMS. Stable carbenes as strong bases. J. Chem. Soc., Chem. Commun.. 1995, s. 1267. DOI 10.1039/c39950001267. (anglicky)
- ↑ Roger W. Alder; MICHAEL E. BLAKE; SIMONE BUFALI; CRAIG P. BUTTS; A. GUY ORPEN; JAN SCHÜTZ; STUART J. WILLIAMS. Preparation of tetraalkylformamidinium salts and related species as precursors to stable carbenes. Journal of the Chemical Society, Perkin Transactions 1. 2001, s. 1586–1593. DOI 10.1039/b104110j. (anglicky)
- ↑ N. Kuhn; T. KRATZ. Synthesis of Imidazol-2-ylidenes by Reduction of Imidazole-2(3H)-thiones. Synthesis. 1993, s. 561–562. DOI 10.1055/s-1993-25902. (anglicky)
- ↑ D. Kovacs; M. S. LEE; D. OLSON; J. E. JACKSON. Carbene-to-Carbene Oxygen Atom Transfer. J. Am. Chem. Soc.. 1996, s. 8144–8145. DOI 10.1021/ja961324j. (anglicky)
- ↑ Michael Otto; SALVADOR CONEJERO; YVES CANAC; VADIM D. ROMANENKO; VALENTYN RUDZEVITCH; GUY BERTRAND. Mono- and Diaminocarbenes from Chloroiminium and -amidinium Salts: Synthesis of Metal-Free Bis(dimethylamino)carbene. J. Am. Chem. Soc.. 2004, s. 1016–1017. DOI 10.1021/ja0393325. PMID 14746458. (anglicky)
- ↑ Massey Richard S. Proton Transfer Reactions of Triazol-3-ylidenes: Kinetic Acidities and Carbon Acid pKaValues for Twenty Triazolium Salts in Aqueous Solution. Journal of the American Chemical Society. 2012, s. 20421–20432. Dostupné online. DOI 10.1021/ja308420c. PMID 23173841. (anglicky)
- ↑ HIGGINS, Eleanor M.; SHERWOOD, Jennifer A.; LINDSAY, Anita G.; ARMSTRONG, James; MASSEY, Richard S.; ALDER, Roger W.; O'DONOGHUE, Annmarie C. P Kas of the conjugate acids of N-heterocyclic carbenes in water. Chem. Commun.. 2011, s. 1559–1561. Dostupné online. DOI 10.1039/C0CC03367G. PMID 21116519. S2CID 205757477. (anglicky)
- ↑ T. A. Taton; P. CHEN. A Stable Tetraazafulvalene. Angew. Chem. Int. Ed. Engl.. 1996, s. 1011–1013. DOI 10.1002/anie.199610111. (anglicky)
- ↑ ALDER, Roger W.; BLAKE, Michael E.; CHAKER, Leila; HARVEY, Jeremy N.; PAOLINI, François; SCHÜTZ, Jan. When and How Do Diaminocarbenes Dimerize?. Angewandte Chemie International Edition. 2004, s. 5896–911. DOI 10.1002/anie.200400654. PMID 15457494. (anglicky)
- ↑ D. Enders, K. Breuer, J. Runsink, and J. H. Teles (1996), Liebigs Ann. Chem., page 2019
- ↑ a b D. Enders, K. Breuer, J. H. Teles, and K. Ebel (1997), Journal Fur Praktische Chemie-Chemiker-Zeitung volume 339, page 397
- ↑ WOLF, J; BÖHLMANN, W; FINDEISEN, M; GELBRICH, T; HOFMANN, HJ; SCHULZE, B. Synthesis of stable isothiazole carbenes. Angewandte Chemie International Edition in English. 2007, s. 3118–21. DOI 10.1002/anie.200604305. PMID 17372997. (anglicky)
- ↑ DEHOPE, A; LAVALLO, V; DONNADIEU, B; SCHOELLER, WW; BERTRAND, G. Recently reported crystalline isothiazole carbenes: Myth or reality. Angewandte Chemie International Edition in English. 2007, s. 6922–5; discussion 6926. DOI 10.1002/anie.200702272. PMID 17661300. (anglicky)
- ↑ Wolf Janine; BÖHLMANN WINFRIED; FINDEISEN MATTHIAS; GELBRICH THOMAS; HOFMANN HANS-JORG; SCHULZE BORBEL. Reply to "Recently Reported Crystalline Isothiazole Carbenes: Myth or Reality". Angew. Chem. Int. Ed.. 2007, s. 6926. DOI 10.1002/anie.200702746. (anglicky)
- ↑ a b Wolfgang A. Herrmann; CHRISTIAN KÖCHER. N-Heterocyclic Carbenes. Angew. Chem. Int. Ed. Engl.. 1997, s. 2162–2187. DOI 10.1002/anie.199721621. (anglicky)
- ↑ Gernot Boche; CHRISTOF HILF; KLAUS HARMS; MICHAEL MARSCH; JOHN C. W. LOHRENZ. Crystal Structure of the Dimeric (4-tert-Butylthiazolato)(glyme)lithium: Carbene Character of a Formyl Anion Equivalent. Angew. Chem. Int. Ed. Engl.. 1995, s. 487–489. DOI 10.1002/anie.199504871. (anglicky)
- ↑ a b D. Enders; H. GIELEN; G. RAABE; J. RUNSINK; J. H. TELES. Synthesis and Stereochemistry of the First Chiral (Imidazolinylidene)- and (Triazolinylidene)palladium(II) Complexes. Chem. Ber.. 1996, s. 1483–1488. DOI 10.1002/cber.19961291213. (anglicky)
- ↑ a b Wolfgang A. Herrmann; MARTINA ELISON; JAKOB FISCHER; CHRISTIAN KÖCHER; GEORG R. J. ARTUS. Metal Complexes of N-Heterocyclic Carbenes - A New Structural Principle for Catalysts in Homogeneous Catalysis. Angew. Chem. Int. Ed. Engl.. 1995, s. 2371–2374. DOI 10.1002/anie.199523711. (anglicky)
- ↑ a b Wolfgang A. Herrmann; LUKAS J. GOOSSEN; CHRISTIAN KÖCHER; GEORG R. J. ARTUS. Chiral Heterocylic Carbenes in Asymmetric Homogeneous Catalysis. Angew. Chem. Int. Ed. Engl.. 1996, s. 2805–2807. DOI 10.1002/anie.199628051. (anglicky)
- ↑ M. Scholl; T. M. TRNKA; J. P. MORGAN; R. H. GRUBBS. Increased ring closing metathesis activity of ruthenium-based olefin metathesis catalysts coordinated with imidazolin-2-ylidene ligands. Tetrahedron Letters. 1999, s. 2247–2250. DOI 10.1016/S0040-4039(99)00217-8. (anglicky)
- ↑ Han Vinh Huynh; HAN, Yuan; JOTHIBASU, Ramasamy; YANG, Jie An. 13C NMR Spectroscopic Determination of Ligand Donor Strengths Using N-Heterocyclic Carbene Complexes of Palladium(II). Organometallics. 2009, s. 5395–5404. DOI 10.1021/om900667d. (anglicky)
- ↑ S. P. Nolan [editor] (2006) N-Heterocyclic carbenes in synthesis, Wiley-VCH ISBN 3-527-31400-8
- ↑ F. Glorius [editor] (2007) N-Heterocyclic carbenes in transition metal catalysis, Springer ISBN 3-540-36929-5
- ↑ DÍEZ-GONZÁLEZ, Silvia; MARION, Nicolas; NOLAN, Steven P. N-Heterocyclic Carbenes in Late Transition Metal Catalysis. Chemical Reviews. 2009-08-12, s. 3612–3676. Dostupné online. ISSN 0009-2665. DOI 10.1021/cr900074m. PMID 19588961. S2CID 206902952. (anglicky)
- ↑ Garrison Jered C.; YOUNGS WILEY J. Ag(I) N-Heterocyclic Carbene Complexes: Synthesis, Structure, and Application. Chemical Reviews. 2005, s. 3978–4008. Dostupné online. DOI 10.1021/cr050004s. PMID 16277368. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Stabilní karbeny na Wikimedia Commons
Obrázky, zvuky či videa k tématu Stabilní karbeny na Wikimedia Commons
Média použitá na této stránce
Imidazol2ylidene pka
Vacuum pyrolysis
Breslow carbene
Autor: Pelirojopajaro, Licence: CC BY-SA 4.0
depiction of delocalization in a stable triplet carbene reported by Tomioka in 2001
Triazol5ylidene reactions
diaminocarbene potasium HMDS complex
Bertrand carbene
Basebuty llithium
Air-free sublimation
Apparatus
a = Rubber cone (typically used to form a vacuum seal in a Büchner flask filtration) which is selected so as to fit snugly around the neck of the Schlenk tube
b = Schlenk tube
c = Gas/vacuum inlet
d = Teflon tap (or stopcock)
e = Syringe
Method steps
1 = Impure solid to sublime (brown) is placed in a Schlenk tube, avoiding contaminating the sides of the tube (e.g. by careful evaporation from a solution containing the brown solid).
2 = Rubber cone (black) is pushed near top of the Schlenk tube (forming a tight seal around flask) and filled with a coolant such as dry ice/acetone (blue/white) to cool the neck of the Schlenk tube. The bottom of the Schlenk tube is heated (red shading) under vacuum (blue arrow), so that the impure solid (brown) sublimes as a pure solid (purple) at the cooled neck area (blue shading).
3 = After sublimation, the cooling-cone (black) is removed, leaving the concentrated impurity as a residue (dark brown) in the bottom of the flask, and the purified sublimed solid (purple) at the neck of the Schlenk tube.
4 = Solvent (blue) is inserted via syringe to dissolve the residue (green/brown), taking care to avoid washing off the sublimed solid (purple).
5 = Residue solution is then removed by syringe (green/brown) (Steps 4 and 5 can be repeated as required).
6 = Purified sublimed solid (purple) is washed off the neck of the flask with fresh solvent (blue) via a syringe.
(In steps 3 to 6 the flask is held under an atmosphere of an inert gas via Schlenk tube side arm).
7 = Solvent is removed under vacuum to give the purified sublimed solid (dark purple).
Steps 6 and 7 are not essentialAlder carbenes
A vectorized version of Alder1.jpg
nzlick carbene
A vectorized version of Arduengo5.jpg
Diaminocarbenes
Dechalcogenation
Structure of Borazine carbene
Dimethyl imidazol-2-ylidene, a stable dicarbene with little steric hindrance
Stable carbene reacts with DMSO
Diaminocarbene dimer
Chen dimer
Heteroaminocarbenes
Deprotonation1
Imidazol2ylidenes
Autor: Miha1391, Licence: CC BY-SA 4.0
Isothiazole carbene (2b) was reported as unstable.
Triazol5ylidenes
Arduengo carbene