Sterické efekty

Sterické efekty jsou jevy, které se objevují při přiblížení atomů v molekulách, kdy se zvyšují energie těchto molekul. Jedná se o nevazebné interakce, které ovlivňují tvar (konformace) a reaktivitu iontů a molekul. Sterické efekty se podobají elektronovým efektům, které také určují tvar a reaktivitu molekul. Sterické odpudivé síly mezi překrývajícími se atomovými orbitaly stabilizují molekuly odpuzováním souhlasných a přitahováním opačných nábojů.
Sterické stínění

Sterické stínění spočívá ve zpomalení chemických reakcí v důsledku sterických efektů. Obvykle se tento pojem objevuje v mezimolekulárních reakcích, zatímco o sterických efektech se často mluví u vnitromolekulárních reakcí. Sterické stínění se často používá k řízení selektivity, například na zpomalení vedlejších reakcí. Sterické odpuzování sousedních skupin může mít vliv na vazebné úhly.
Jako příklady mohou sloužit pozorovaný tvar molekuly rotaxanů a pomalý průběh racemizací 2,2'-disubstituovaných bifenylů a binaftylů.
Měření sterických vlastností
Protože sterické efekty pozměňují vlastnosti sloučenin, tak lze, několika různými způsoby, kvantitativně měřit sterické vlastnosti substituentů.
Rychlosti reakcí
Relativní rychlosti chemických reakcí jsou dobrým způsobem zkoumání sterických účinků substituentů. Brommethan se za běžných podmínek solvolyzuje 107krát rychleji než 1-brom-2,2-dimethylpropan. Rozdíl je způsoben znesnadněním ataku druhé sloučeniny v důsledku sterického stínění terc skupinou.[3]
Teplota depolymerizace
Teplota depolymerizace () popisuje sterické vlastnosti monomeru vytvářejícího polymer. Jedná se o teplotu, při které jsou rychlosti polymerizační a depolymerizační reakce stejné. Stericky stíněné monomery vytvářejí polymery s nízkými , které obvykle nejsou prakticky využitelné.
| Monomer | Teplota depolymerizace (°C)[4] | ! Struktura |
|---|---|---|
| ethen | 610 | CH2=CH2 |
| isobuten | 175 | CH2=CMe2 |
| buta-1,3-dien | 585 | CH2=CHCH=CH2 |
| isopren | 466 | CH2=C(Me)CH=CH2 |
| styren | 395 | PhCH=CH2 |
| α-methylstyren | 66 | PhC(Me)=CH2 |
Tolmanův úhel

Tolmanův úhel udává velikost daného ligandu. Definován je jako úhel vymezený atomem kovu a krajními body van der Waalsových sfér atomů ligandu na průměru kuželu (viz obrázek).[5]
| Ligand | Úhel (°) |
|---|---|
| PH3 | 87 |
| P(OCH3)3 | 107 |
| P(CH3)3 | 118 |
| P(CH2CH3)3 | 132 |
| P(C6H5)3 | 145 |
| P(cyklo-C6H11)3 | 179 |
| P(t-Bu)3 | 182 |
| P(2,4,6-Me3C6H2)3 | 212 |
Význam a využití
Sterické efekty významně ovlivňují chemické, biochemické a farmakologické vlastnosti sloučenin, jako jsou rychlosti a aktivační energie reakcí.
V biochemii se sterické efekty vyskytují například u enzymů, kde může být katalytické místo zakryto rozměrnější strukturou bílkoviny. Ve farmakologii určují sterické efekty, jak a s jakou rychlostí léčiva interagují s cílovými biomolekulami.
- Příklady stericky stericky stíněných sloučenin
- Tris(2,4-di-terc-butylfenyl)fosfit, sloučenina používaná jako stabilizátor polymerů
- Tricyklohexylfosfin, fosfinový ligand používaný v homogenní katalýze a s tris(pentafluorofenyl)boranem vytvářející frustrovaný Lewisův pár.[6]
- 2,6-di-terc-butylfenol se používá v průmyslu ke stabilizování materiálů vůči ultrafialovému záření a jako antioxidant pro uhlovodíkové výrobky od ropných produktů po plasty.<ref>{{Citace monografie
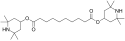
- Stericky stíněné aminové světelné stabilizátory jsou častými přísadami v polymerech.<ref>{{Citace monografie
- Selenenová kyselina, kterou lze díky sterické ochraně izolovat<ref>{{Citace periodika
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Steric effects na anglické Wikipedii.
- ↑ Günther Maier; Stephan Pfriem; Ulrich Schäfer; Rudolf Matusch. Tetra-tert-butyltetrahedrane. Angewandte Chemie International Edition in English. 1978, s. 520–521. DOI 10.1002/anie.197805201.
- ↑ Michael Gait. Oligonucleotide synthesis: a practical approach. Oxford: IRL Press, 1984. ISBN 0-904147-74-6.
- ↑ SMITH, Michael, October 17-. March's advanced organic chemistry : reactions, mechanisms, and structure.. 6th ed.. vyd. Hoboken, N.J.: Wiley-Interscience, 2007. xx, 2357 pages s. Dostupné online. ISBN 0-471-72091-7, ISBN 978-0-471-72091-1.
- ↑ Malcolm P. Stevens. Polymer Chemistry an Introduction. New York: Oxford University Press, 1999. Dostupné online. Kapitola 6, s. 193–194.
- ↑ Chadwick A. Tolman. Phosphorus ligand exchange equilibriums on zerovalent nickel. Dominant role for steric effects. Journal of the American Chemical Society. 1970, s. 2956–2965. DOI 10.1021/ja00713a007.
- ↑ Stephan, Douglas W. „Frustrated Lewis pairs“: a concept for new reactivity and catalysis. Organic and Biomolecular Chemistry 2008, 6, 1535–1539 DOI:10.1039/b802575b
Externí odkazy
 Obrázky, zvuky či videa k tématu Sterické efekty na Wikimedia Commons
Obrázky, zvuky či videa k tématu Sterické efekty na Wikimedia Commons - 25, 2008/https://web.archive.org/web/20080725021620/http://www.chem.swin.edu.au/modules/mod4/qsarwebp4.html Steric Effects (chem.swin.edu.au) na Internet Archive. (archivováno 25. 7. 2008)
- 22, 2017/https://web.archive.org/web/20171222052426/http://www.gh.wits.ac.za/craig/steric/ Steric: A Program to Calculate the Steric Size of Molecules (gh.wits.ac.za) na Internet Archive. (archivováno 22. 12. 2017)
Související články
- Srážková teorie
- Thorpeův–Ingoldův efekt - urychlení reakce v důsledku sterického stínění
- Stericky indukovaná redukce
- Molekulové interakce
- Van der Waalsovo napětí, také označované jako sterické napětí
Média použitá na této stránce
structure of titanium isopropoxide
Autor: Michał Sobkowski, Licence: CC BY-SA 4.0
Regioselective tritylation of thymidine with dimethoxytrityl chloride
Structure of bis(2,2,6,6-tetramethylpiperidin-4-yl) decanedioate
Skeleton of cyclobutadiene, which is unstable for R = H but stable for R = tert-butyl.
Autor: Hbf878, Licence: CC0
Chemical structure of 2,6-di-tert-butylphenol.
Skeletal formula of tricyclohexylphosphine

![Tricyklohexylfosfin, fosfinový ligand používaný v homogenní katalýze a s tris(pentafluorofenyl)boranem vytvářející frustrovaný Lewisův pár.[6]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/eb/Tricyclohexylphosphine-2D-skeletal.png/157px-Tricyclohexylphosphine-2D-skeletal.png)