Sulfid barnatý
| Sulfid barnatý | |
|---|---|
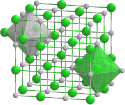
(c) Goran tek-en, CC BY-SA 4.0 Krystalová struktura sulfidu barnatého __ Ba2+ __ S2− | |
| Obecné | |
| Systematický název | Sulfid barnatý |
| Anglický název | Barium sulfide |
| Německý název | Bariumsulfid |
| Sumární vzorec | BaS |
| Vzhled | bílý prášek nebo krystalky |
| Identifikace | |
| Registrační číslo CAS | 21109-95-5 |
| EC-no (EINECS/ELINCS/NLP) | 244-214-4 |
| PubChem | 6857597 |
| ChEBI | 32590 |
| Vlastnosti | |
| Molární hmotnost | 169,40 g/mol |
| Teplota tání | 1 200 °C |
| Hustota | 4,332 g/cm3 (0 °C) 4,25 g/cm3 (15 °C) |
| Index lomu | nD= 2,155 |
| Rozpustnost ve vodě | 2,88 g/100 g (0 °C) 4,89 g/100 g (10 °C) 7,86 g/100 g (20 °C) 10,38 g/100 g (30 °C) 14,89 g/100 g (40 °C) 27,7 g/100 g (60 °C) 49,9 g/100 g (80 °C) 60,3 g/100 g (100 °C) |
| Rozpustnost v polárních rozpouštědlech | methanol (málo) ethanol (ne) |
| Struktura | |
| Krystalová struktura | krychlová |
| Hrana krystalové mřížky | a=636 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −460 kJ/mol |
| Standardní molární entropie S° | 78,2 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −456 kJ/mol |
| Izobarické měrné teplo cp | 0,291 5 JK−1g−1 |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | R20/22, R31, R50 |
| S-věty | (S2), S28, S61 |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Sulfid barnatý je anorganická sloučenina se vzorcem BaS. Chalkogenidy kovů alkalických zemin jsou nyní intenzivně studovány jako kandidáti na krátkovlnné emitery pro elektronické displeje.[2] BaS se považuje za nejdůležitější syntetickou sloučeninu barya, je prekurzorem BaCO3 a pigmentu lithoponu (ZnS/BaSO4).[3]
Objevení, výroba, vlastnosti
Jako první sulfid barnatý připravil Vincentius (či Vincentinus) Casciarolus (nebo Casciorolus, 1571-1624) postupem, který je dnes znám jako „karbotermická redukce“. Místo uhlíku však použil mouku:[4]
- BaSO4 + 2 C → BaS + 2 CO2
Látka byla díky své fosforescenci výjimečná a mnoho alchymistů a chemiků pak experimentovalo s materiálem známým jako Lapis Boloniensis (česky „boloňský kámen“) či Chrysolapis.[5][6][7]
Andreas Sigismund Marggraf ukázal, že kalcit a sádra nejsou příliš vhodné pro výrobu boloňského kamene (na rozdíl od fluoritu), nakonec došel k závěru, že materiálem, ze kterého je boloňský kámen vyroben, je síran vápenatý.[8]
BaSO4 je k dispozici v podobě běžného nerostu barytu.
Sulfid barnatý taje při 1 200 °C, krystalizuje ve struktuře charakteru NaCl. Je bezbarvý, ovšem podobně jako jiné sulfidy se často vyskytuje v nečistých zbarvených formách. Nyní se vyrábí vylepšenou verzí Casciarolova postupu: místo mouky se používá koks.
Bezpečnost
BaS je jedovatý. Při kontaktu s vodou se (podobně jako u některých jiných sulfidů) uvolňuje velmi toxický plyn sulfan. Problémem může být záměna za síran barnatý, který je neškodný a podává se ve velkém množství jako rentgenová kontrastní látka. Pokud se omylem použije sulfid barnatý, způsobí to smrtelnou otravu.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Barium sulfide na anglické Wikipedii.
- ↑ a b Barium sulfide (Ba(Sx)). pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Vij, D. R.; Singh, N. "Optical and electrical properties of II-VI wide gap semiconducting barium sulfide" Proceedings of SPIE (1992), 1523 (Conf. Phys. Technol. Semicond. Devices Integr. Circuits, 1992), 608-12.
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ F. Licetus, Litheosphorus, sive de lapide Bononiensi lucem in se conceptam ab ambiente claro mox in tenebris mire conservante, Utini, ex typ. N. Schiratti, 1640. See http://www.chem.leeds.ac.uk/delights/texts/Demonstration_21.htm Archivováno 13. 8. 2011 na Wayback Machine.
- ↑ Lapis Boloniensis [online]. www.zeno.org. Dostupné online. (anglicky)
- ↑ Lemery, Nicolas. Trait℗e universel des drogues simples. [s.l.]: [s.n.], 1714. Dostupné online. (anglicky)
- ↑ Ozanam, Jacques; MONTUCLA, JEAN ETIENNE; HUTTON, CHARLES. Recreations in mathematics and natural philosophy ... [s.l.]: [s.n.], 1814. Dostupné online. (anglicky)
- ↑ Marggraf, Andreas Sigismund. Chymische Schriften. [s.l.]: [s.n.], 1767. Dostupné online. (anglicky)
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
(c) Goran tek-en, CC BY-SA 4.0
Crystal structure of NaCl with coordination polyhedra