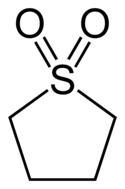
Sulfolan
| Sulfolan | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 1λ6-thiolan-1,1-dion |
| Ostatní názvy | tetramethylensulfon |
| Sumární vzorec | C4H8SO2 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 126-33-0 |
| EC-no (EINECS/ELINCS/NLP) | 204-783-1 |
| PubChem | 31347 |
| SMILES | C1CCS(=O)(=O)C1 |
| InChI | 1S/C4H8O2S/c5-7(6)3-1-2-4-7/h1-4H2 |
| Číslo RTECS | XN0700000 |
| Vlastnosti | |
| Molární hmotnost | 120,17 g/mol |
| Teplota tání | 27,6 °C (300,8 K)[1] |
| Teplota varu | 285 °C (558 K)[1] |
| Hustota | 1,2606 g/cm3 (30 °C)[1] |
| Dynamický viskozitní koeficient | 10,34 cP (30 °C)[1] |
| Index lomu | 1,481 (30 °C)[1] |
| Rozpustnost ve vodě | mísitelný[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v alkanech, naftenech a toluenu[1] |
| Tlak páry | 0,83 Pa (27,6 °C)[1] |
| Termodynamické vlastnosti | |
| Standardní molární spalná entalpie ΔH°sp | −2670 kJ/mol[1] |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H302[1] |
| P-věty | P264 P270 P301+312 P330 P501[1] |
| Teplota vzplanutí | 177 °C (450 K)[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Sulfolan (systematický název 1λ6-thiolan-1,1-dion) je organická sloučenina, v podstatě cyklický sulfon. Používá se v chemickém průmyslu jako rozpouštědlo. Původně byl vyvinut jako rozpouštědlo k přečišťování butadienu.[2][3] Jedná se o aprotické polární rozpouštědlo snadno rozpustné ve vodě.
Vlastnosti
Sulfolan patří mezi sulfony, organické sloučeniny obsahující sulfonylové funkční skupiny. V sulfonové skupině se nachází atom síry, na který jsou dvojnými vazbami navázány dva atomy kyslíku a jednoduchými vazbami dvě uhlíkatá centra. Dvojná vazba mezi sírou a kyslíkem je polární, díky čemuž je tato látka dobře rozpustná ve vodě, zatímco čtyřčlenný uhlovodíkový řetězec v cyklu vytváří nepolární část molekuly. Díky tomu se sulfolan mísí s vodou i uhlovodíky, a tak se často používá jako rozpouštědlo k čištění směsí uhlovodíků.
Výroba
Původní metoda výroby sulfolanu vyvinutá v Shell Oil Company spočívala v reakci butadienu s oxidem siřičitým cheletropní reakcí za vzniku sulfolenu, který byl následně hydrogenován pomocí Raneyova niklu jako katalyzátoru na sulfolan.[4][5]
Krátce po objevu této výroby bylo zjištěno, že výtěžnost reakce i životnost katalyzátoru lze zlepšit přidáním peroxidu vodíku a úpravou pH na 5 až 8 před začátkem hydrogenace. V následujících letech pokračoval vývoj této metody, zaměřený převážně na katalyzátory. Zjistilo se, že Ni-B/MgO má vyšší katalytickou aktivitu než Raneyův nikl a jiné katalyzátory běžně používané při hydrogenaci sulfolenu.
Byly vyvinuty i další postupy, jako například oxidace thiolanu (tetrahydrothiofenu) peroxidem vodíku. Touto reakcí vzniká tetramethylensulfoxid, který je možné dále oxidovat. První oxidace probíhá za nízkých teplot, zatímco druhá za vysokých, takže je možné ovládat průběh reakce, díky čemuž může být dosaženo větší výtěžnosti i čistoty produktu.
Použití
Sulfolan se používá jako průmyslové rozpouštědlo, nejčastěji při extrakci aromatických uhlovodíků ze směsí uhlovodíků a přečišťování zemního plynu.[4] Prvním významným průmyslovým využitím sulfolanu byl sulfinolový proces, který byl zaveden Shell Oil Company v roce 1964. Spočívá v odstraňování H2S, CO2, COS a thiolů ze zemního plynu pomocí směsi alkanolaminů a sulfolanu.
Krátce po zavedení sulfinolového procesu bylo zjištěno, že sulfolan lze použít k účinnému oddělování aromatických sloučenin ze směsí uhlovodíků s využitím kapalinové extrakce. Tento postup se používá v ropných rafineriích a petrochemickém průmyslu. Jelikož je sulfolan jedním z nejúčinnějších průmyslových rozpouštědel, co se týče přečišťování aromatických sloučenin, tak je méně nákladný než jiná rozpouštědla používaná k tomuto účelu. Díky své selektivitě je také vhodným doplňkem destilace; pokud nelze sloučeniny dobře oddělit pomocí sulfolanu, použije se destilace a naopak.
Přestože je sulfolan velmi stabilní a jeho použití tak lze mnohokrát opakovat, tak se pomalu rozkládá na kyselé sloučeniny. K jejich odstranění se používá několik různých postupů, díky kterým může být sulfolan použít vícekrát a životnost zařízení se prodlužuje. K regeneraci použitého sulfolanu se používá několik metod, například vakuová destilace a destilace s vodní parou, adsorpce a iontoměničové kolony.
Sulfolan se rovněž přidává do kyseliny fluorovodíkové, kde omezuje tvorbu par[6] v alkylačních jednotkách.
Reference
V tomto článku byl použit překlad textu z článku Sulfolane na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m n o p Sulfolane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Young, Eldred E. (Shell International Research) BE Patent 616856, 1962
- ↑ Goodenbour, John W.; Carlson, George J. (Shell International Research) BE Patent 611850, 1962
- ↑ a b Hillis O. Folkins, "Benzene" in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI:10.1002/14356007.a03_475
- ↑ Earl Clark, Kirk-Othmer Encyclopedia of Chemical Technology, "Sulfolane and Sulfones", John Wiley & Sons, NY, 1997
- ↑ Sulfolane Fact Sheet [online]. Chevron Phillips Chemical Company [cit. 2021-01-01]. Dostupné v archivu pořízeném dne 2018-11-23.
Externí odkazy
 Obrázky, zvuky či videa k tématu Sulfolan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Sulfolan na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Skeletal formula of sulfolane
Ball-and-stick model of the sulfolane molecule