Superoxid draselný
| Superoxid draselný | |
|---|---|
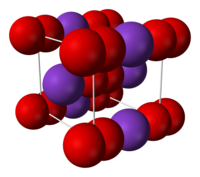 Model krystalové mřížky superoxidu draselného | |
| Obecné | |
| Systematický název | superoxid draselný |
| Ostatní názvy | hyperoxid draselný |
| Anglický název | Potassium superoxide, Potassium dioxide |
| Německý název | Kaliumhyperoxid, Kaliumsuperoxid |
| Sumární vzorec | KO2 |
| Vzhled | žlutá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 12030-88-5 |
| EC-no (EINECS/ELINCS/NLP) | 234-746-5 |
| UN kód | 2466 |
| Číslo RTECS | TT6053000 |
| Vlastnosti | |
| Molární hmotnost | 71,1 g/mol |
| Teplota tání | 490—530 °C (rozklad na K2O2 a O2 |
| Hustota | 2,158 g/cm3 |
| Rozpustnost ve vodě | reaguje za vzniku KOH a O2 |
| Struktura | |
| Krystalová struktura | tetragonální, I 4/mmm, |
| Hrana krystalové mřížky | a = 570 pm, c = 672 pm, Z = 4 |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −283 kJ/mol−1 |
| Standardní molární entropie S° | 117 JK−1mol−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R8 - R35 |
| S-věty | S17 - S26 S36/37/39 - S45 |
| NFPA 704 | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Superoxid draselný (KO2) je sloučenina draslíku a kyslíku. Je to jedna z mála existujících solí se superoxidovým aniontem O=O−. Další jsou: CsO2, RbO2 a nejméně stabilní NaO2. Superoxid draselný nelze pojmenovat jako „oxid drasličitý“, stejně jako ostatní superoxidy, protože draslík zde vystupuje jako jednomocný kation K+. Vyrábí se spalováním roztaveného draslíku v čistém kyslíku:
Používá se jako oxidační činidlo, jako pohlcovač oxidu uhličitého CO2 a vlhkosti, zároveň produkujícím kyslík v systémech obnovy vydýchaného vzduchu v uzavřeném koloběhu v kosmických lodích, ponorkách a podobně.
- 4 KO2 + 2 H2O → 4 KOH + 3 O2
- 2 KOH + CO2 → K2CO3 + H2O
- K2CO3 + CO2 + H2O → 2 KHCO3
- 4 KO2 + 2 CO2 → 2 K2CO3 + 3 O2
- 2 KOH + CO2 → K2CO3 + H2O
S větším množstvím vody reaguje až explozivně, také reaguje s ethanolem. Je nestabilní a při zahřívání ve vakuu odštěpuje kyslík:
Při rozkladu působením zředěných kyselin vzniká i peroxid vodíku a kyslík:
Při reakci s koncentrovanou kyselinou sírovou (H2SO4) se uvolňuje ozón:
Reference
V tomto článku byl použit překlad textu z článku Potassium superoxide na anglické Wikipedii.
- ↑ a b Potassium superoxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Superoxid draselný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Superoxid draselný na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Ball-and-stick model of the unit cell of potassium superoxide, KO2
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances






