Suzukiova reakce
Suzukiova reakce (někdy nazývaná Suzukiova–Mijaurova reakce) je organická reakce boronové kyseliny s organohalogenidem a jako katalyzátor slouží komplex palladia v oxidačním čísle 0.[1][2][3]
Tuto reakci popsal Akira Suzuki v roce 1979 a roku 2010 získal společně s Richardem F. Heckem a Eičim Negišim Nobelovu cenu za chemii za využití palladia jako katalyzátoru při syntéze organických molekul.[4]
Tato reakce se používá na přípravu polyalkenů, styrenů a substituovaných bifenylů. Bylo vydáno několik studií popisujících vylepšení a rozvoj Suzukiovy reakce.[5][3][6]
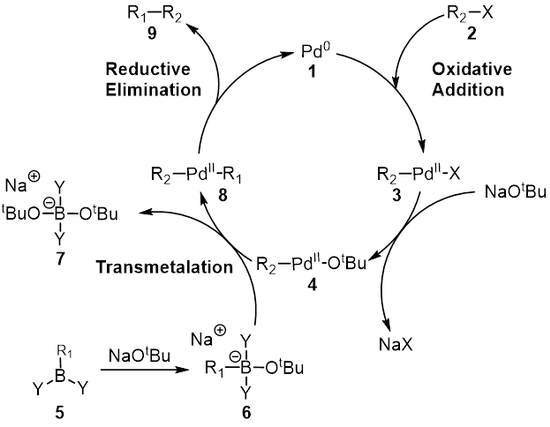
Obecné schéma Suzukiovy reakce je znázorněno níže; jednoduchá vazba mezi atomy uhlíku vzniká reakcí organoborité sloučeniny (R1-BY2) s organohalohenidem (R2-X) za přítomnosti palladiového katalyzátoru a zásady.
: |
| () |
Mechanismus
Mechanismus Suzukiovy reakce lze nejlépe ukázat na palladiovém katalyzátoru 1. Prvním krokem je oxidační adice palladia na organohalogenid 2, kterou se vytvoří organopalladnatá sloučenina 3. Reakcí se zásadou vznikne meziprodukt 4, který se transmetalační reakcí[7] s boronátovým komplexem 6 (vytvořeným reakcí boronové kyseliny 5 se zásadou) přemění na organopalladnatou sloučeninu 8. Redukční eliminací se následně vytvoří konečný produkt 9 a obnoví katalyzátor 1, čímž ze zakončí katalytický cyklus. Suzukiova reakce probíhá za přítomnosti zásady, přičemž význam zásady dlouho nebyl zcela znám. Nejprve se předpokládalo, že zásada vytvoří trialkylborát (R3B-OR) reakcí trialkylboranu (BR3) s alkoxidem (−OR), který je silnějším nukleofilem a tak s palladnatým komplexem vzniklým v transmetalačním kroku reaguje rychleji.[8][9][10]
Gaëtan Le Duc se svými spolupracovníky zkoumal vliv zásady na reakční mechanismus Suzukiovy reakce a zjistil, že zde zásady slouží třem účelům: tvorbě palladnatého komplexu [ArPd(OR)L2] a trialkylborátu, a také urychlení redukční eliminace reakcí alkoxidu s palladnatým komplexem.[8]
Oxidační adice
Oxidační adice je ve většině případů krokem určujícím rychlost Suzukiovy reakce.[11]
Během tohoto kroku je palladium v katalyzátoru oxidováno z oxidačního čísla 0 na II. Katalyzátor 1 reaguje s alkylhalogenidem 2 za tvorby organopalladnatého komplexu 3. Dochází přitom k zániku vazby mezi uhlíkem a halogenem a palladium je nově navázáno na halogen i skupinu R.

Při oxidační adici se zachovává stereoizomerie vinylhalogenidů, ovšem u allyl- a benzylhalogenidů se obrací.[12]
Oxidační adicí se vytváří cis-palladnatý komplex, jenž se izomerizuje na trans-komplex.[13]

Při Suzukiově reakci se konfigurace dvojných vazeb nemění ani u organoboritého činidla ani u halogenidu.[14] Její konfigurace je ovšem určována cis-trans izomerizací palladnatého komplexu při oxidační adici, kdy trans-palladnatý komplex převažuje. Po navázání organoborité sloučeniny a alkenylhalogenidu na dvojnou vazbu se vytváří dien:

Transmetalace
Transmetalace je organokovová reakce, při které se ligandy přesouvají z jedné molekuly na druhou. U Suzukiovy reakce jde o přesun z organoborité sloučeniny 6 na palladnatý komplex 4, kdy se zásada vymění s R1 substituentem organoborité sloučeniny za vzniku nového palladnatého komplexu 8. Přesný mechanismus transmetalace u Suzukiovy reakce není znám. Organoborité sloučeniny nevstupují do transmetalací, pokud není přítomna zásada a tak se předpokládá, že zásada aktivuje organoboritou sloučeninu a usnadňuje tvorbu R2-Pdll-OtBu z R2-Pdll-X.[11]

Redukční eliminace
Posledním krokem je redukční eliminace, při níž se z palladnatého komplexu (8) odštěpí výsledný produkt (9) a obnoví se katalyzátor(1). Pomocí deuteriového značkování bylo zjištěno, že se stereochemie při redukční eliminaci zachovává.[15]

Důležitou roli má u Suzukiovy reakce také výběr ligandu, nejčastěji se používají fosfinové ligandy. Fosfinové ligandy navyšují elektronovou hustotu na kovovém centru a tak podporují oxidační adici. Jejich substituenty zase svými sterickými efekty podporují redukční eliminaci. Fosfinové ligandy jsou ovšem, kvůli své nestabilitě za podmínek reakce, nahrazovány N-heterocyklickými karbeny.[16]
N-heterocyklické karbeny mají vyšší elektronové hustoty a silnější sterické efekty než fosfinové ligandy. a tak lépe stabilizují katalyzátory.[17]
Výhody
Výhodami Suzukiovy reakce oproti jiným podobným metodám jsou dostupnost běžných boronových kyselin, mírné reakční podmínky a nižší toxicita používaných sloučenin. Boronové kyseliny jsou méně toxické a pro životní prostředí bezpečnější než organocínové a organozinečnaté sloučeniny. Anorganické vedlejší produkty lze z reakční směsi snadno odstranit. Tato reakce se upřednostňuje, protože reaktanty jsou poměrně levné a snadno se připravují. Díky možnosti použít jako rozpouštědlo vodu[18] je tato reakce méně nákladná, šetrnější k životnímu prostředí a navíc lze použít velké množství různých reaktantů rozpustných ve vodě, například aryl- a vinylboronové kyseliny a aryl- či vinylhalogenidy. Byly také vyvinuty varianty využívající alkylbromidy.[19]
Kromě řady rozdílných halogenidů lze při Suzukiově reakci také použít pseudohalogenidy, jako jsou trifláty (OTf). Relativní reaktivita při použití halogenidů a pseudohalogenidů klesá v této řadě: R2–I > R2–OTf > R2–Br >> R2–Cl. Boronové kyseliny lze nahradit jejich estery či trifluorborátové soli. Katalyzátor může být založen na nanočásticích palladia.[20]
Pomocí fosfinového ligandu SPhos lze množství potřebného katalyzátoru snížit až na 0,001 molárních procent.[21]
Díky těmto vlastnostem je Suzukiova reakce často používaným syntetickým postupem.
Využití
V průmyslu
Suzukiova reakce se využívá k průmyslové syntéze meziproduktů při výrobě léčiv a čistých chemikálií.[22] V minulosti její využití omezovaly vysoké ceny katalyzátorů a špatná dostupnost boronových kyselin. Průmyslovými Suzukiovými reakcemi se vyrábí řada biologicky aktivních látek, jako je CI-1034, při jehož výrobě se používá triflát a boronová kyselina, kdy při použití 80 kg reaktantů dosahuje výtěžnost 95 %.[23]
Dalším příkladem je reakce 3-pyridylboranu s 1-brom-3-(methylsulfonyl)benzenem, kterou se vytváří meziprodukt, z něhož může být získána látka s účinky na centrální nervovou soustavu. Při reakci se vytváří 278 kg produktu s 92,5% výtěžností.[14][22]

Významných pokroků bylo dosaženo při vývoji heterogenních katalyzátorů Suzukiovy reakce, což má využití v průmyslu (usnadňuje oddělení katalyzátoru od substrátu); ukázalo se, že katalýza jednoatomovými heterogenními Pd katalyzátory je vhodnější než homogenní katalýza pomocí Pd(PPh3)4.[24]
V laboratořích
Suzukiova reakce má využití při syntézách složitých organických struktur.[25][26]
Suzukiova reakce byla použita na přípravu derivátu citronellalu, sloužícího jako meziprodukt přípravy kaparratrienu, látky aktivní proti leukémii:[27]

Obměny
Katalyzátory
Pro Suzukiovy reakce bylo vyvinuto i několik katalyzátorů založených na jiných kovech (především niklu), než je palladium;[28] první taková reakce katalyzovaná niklem byla popsána v roce 1995 a byly při ní použity arylové mesyláty a boronové kyseliny.[29]
I když je při této variantě reakce potřeba velké množství katalyzátoru (okolo 5 molárních procent), tak je méně nákladná díky nižší ceně niklu oproti palladiu. Katalýza Suzukiových reakcí niklem také umožňuje použití řady sloučenin, u kterých reakce při použití palladiového katalyzátoru neprobíhá nebo probíhá hůře.[28] S niklovými katalyzátory lze jako reaktanty použít elektrofily, jejichž reakce za přítomnosti palladiových katalyzátorů jsou obtížně proveditelné, což jsou například fenoly, arylethery, estery, organofosfáty a fluoridy.[28]

Dalším zkoumáním katalyzátorů založených na niklu byly rozšířeny možnosti Suzukiovy reakce a zájem o její výzkum vzrostl. V roce 2000 byl popsán levnější niklový katalyzátor obsahující trifenylfosfinové (PPh3) ligandy místo dražších, které se používaly dříve.[30]
Při niklem katalyzovaných Suzukiových reakcích jsou potřeba velká množství katalyzátoru (3 až 10 molárních procent), což vyžaduje velký přebytek ligandu (1 až 5 ekvivalentů) a katalyzátor je citlivý na vzduch a vlhkost.[28] K překonání těchto nedostatků byl vyvinut postup využívající malé množství katalyzátoru (<1 mol %) a nevyžadující nadbytek ligandu.[31]

Také byl popsán vysoce aktivní niklový katalyzátor, u kterého k provedení reakce stačí 0,01 až 0,1 mol % a lze jej recyklovat až šestkrát bez pozorovatelné ztráty katalytické aktivity.[32]

Obe varianty Suzukiovy reakce (niklem i palladiem katalyzované) mají své výhody i nevýhody. Byly však vyvinuty i jiné katalytické systémy, založené například na železu nebo mědi.[33]
Dvě skupiny výzkumníků[34][35] se intenzivně zabývaly rozvojem Suzukiových reakcí katalyzovaných železem.
Dalším kovem použitelným jako součást katalyzátorů Suzukiových reakcí je ruthenium.[36]
Použití amidů
Sloučeninami niklu lze také katalyzovat tvorbu vazeb C-C z amidů. I přes nízkou reaktivitu amidů lze na přípravu vazeb C-C použít níže uvedený postup, jenž probíhá za mírných podmínek a umožňuje zapojení velkého počtu různých funkčních skupin, jako jsou aminy, ketony, heterocyklické sloučeniny a skupiny obsahující kyselé protony; může rovněž sloužit k přípravě biologicky aktivních molekul a kontrolované tvorbě heterocyklů.[37]

Sloučenina navazující se na tubulin (působící tak jako cytostatikum) byla připravena reakcí trimethoxyamidu a heterocyklického reaktantu.[37]

Organoborany
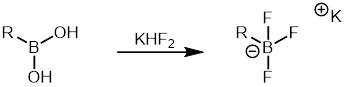
Arylboronové kyseliny jsou levnější než jiné organoborany a jsou dostupné ve velkém počtu; díky tomu jsou často používanými reaktanty v Suzukiových reakcích. Lze také použít aryltrifluorboritanové soli, které jsou méně náchylné k protodeboracím než boronové kyseliny. Dají se snadno připravit a přečistit.[38]
Aryltrifluorboritanové soli lze vytvořit z boronových kyselin reakcí s hydrogendifluoridem draselným a následně použít při Suzukiově reakci.[39]

Rozpouštědla
Suzukiova reakce se od ostatních podobných reakcí liší tím, že může probíhat jak v dvoufázovém prostředí tvořeném organickým rozpouštědlem a vodou[40] či samotnou vodou,[18] případně neobsahujícím žádné rozpouštědlo.[41]
Tímto se rozšiřují možnosti reakce, protože lze použít mnoho různých ve vodě rozpustných zásad, katalyzátor a reaktantů bez zohledňování jejich rozpustnosti v organických rozpouštědlech. Použití vody jako rozpouštědla má též ekonomické a bezpečnostní výhody. Často používanými rozpouštědly jsou toluen,[42] tetrahydrofuran,[43] dioxan[43] a dimethylformamid.[44] Jako zásady mohou být použity například uhličitan draselný,[40] terc-butoxid draselný,[45] uhličitan cesný,[46] fosforečnan draselný,[47] hydroxid sodný[48] a triethylamin.[49]
Odkazy
Související články
- Chanova–Lamova reakce
- Heckova reakce
- Hijamova reakce
- Kumadova reakce
- Negišiova reakce
- Petasisova reakce
- Sonogaširova reakce
- Stilleov reakce
Externí odkazy
 Obrázky, zvuky či videa k tématu Suzukiova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Suzukiova reakce na Wikimedia Commons - Mechanism In Motion: Suzuki coupling [online]. Dostupné online.
Reference
V tomto článku byl použit překlad textu z článku Suzuki reaction na anglické Wikipedii.
- ↑ Norio Miyaura; Kinji Yamada; Akira Suzuki. A new stereospecific cross-coupling by the palladium-catalyzed reaction of 1-alkenylboranes with 1-alkenyl or 1-alkynyl halides. Tetrahedron Letters. 1979, s. 3437–3440. Dostupné v archivu pořízeném dne 2014-10-21. doi:10.1016/S0040-4039(01)95429-2.
- ↑ Norio Miyaura; Akira Suzuki. Stereoselective synthesis of arylated (E)-alkenes by the reaction of alk-1-enylboranes with aryl halides in the presence of palladium catalyst. Chemical Communications. 1979, s. 866–867. doi:10.1039/C39790000866.
- ↑ a b Norio Miyaura; Akira Suzuki. Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds. Chemical Reviews. 1979, s. 2457–2483. Dostupné v archivu pořízeném dne 2016-09-12. doi:10.1021/cr00039a007.
- ↑ The Nobel Prize in Chemistry 2010 [online]. [cit. 2013-10-25]. Dostupné online.
- ↑ Akira Suzuki. Synthetic Studies via the cross-coupling reaction of organoboron derivatives with organic halides. Pure and Applied Chemistry. 1991, s. 419–422. doi:10.1351/pac199163030419.
- ↑ Akira Suzuki. Recent advances in the cross-coupling reactions of organoboron derivatives with organic electrophiles, 1995–1998. Journal of Organometallic Chemistry. 1999, s. 147–168. Dostupné v archivu pořízeném dne 2016-09-12. doi:10.1021/cr00039a007.
- ↑ K. Matos; J. A. Soderquist. Alkylboranes in the Suzuki−Miyaura Coupling: Stereochemical and Mechanistic Studies. The Journal of Organic Chemistry. 1998, s. 461–470. doi:10.1021/jo971681s. PMID 11672034.
- ↑ a b Christian Amatore; Anny Jutand; Gaëtan Le Duc. Kinetic Data for the Transmetalation/Reductive Elimination in Palladium-Catalyzed Suzuki-Miyaura Reactions: Unexpected Triple Role of Hydroxide Ions Used as Base. Chemistry: A European Journal. 2011-02-18, s. 2492–2503. doi:10.1002/chem.201001911. PMID 21319240.
- ↑ George B. Smith; George C. Dezeny; David L. Hughes; Anthony O. King; Thomas R. Verhoeven. Mechanistic Studies of the Suzuki Cross-Coupling Reaction. The Journal of Organic Chemistry. 1994-12-01, s. 8151–8156. doi:10.1021/jo00105a036.
- ↑ Karl Matos; John A. Soderquist. Alkylboranes in the Suzuki−Miyaura Coupling: Stereochemical and Mechanistic Studies. The Journal of Organic Chemistry. 1998-02-01, s. 461–470. doi:10.1021/jo971681s. PMID 11672034.
- ↑ a b Laszlo Kurti. Strategic Applications of Named Reactions in Organic Synthesis. [s.l.]: Elsevier Academic Press, 2005. Dostupné online. ISBN 978-0124297852.
- ↑ John K. Stille; Kreisler S. Y. Lau. Mechanisms of oxidative addition of organic halides to Group 8 transition-metal complexes. Accounts of Chemical Research. 1977, s. 434–442. doi:10.1021/ar50120a002.
- ↑ Arturo L. Casado; Pablo Espinet. On the Configuration Resulting from Oxidative Addition of RX to Pd(PPh3)4and the Mechanism of the cis-to-trans Isomerization of \PdRX(PPh3)2] Complexes (R = aryl, X = halide)†. Organometallics. 1998, s. 954–959. doi:10.1021/om9709502.
- ↑ a b Advanced Organic Chemistry. [s.l.]: Springer, 2007. Dostupné online. doi:10.1002/tcr.201300001. PMID 23568378. S. 739–747.
- ↑ Brian H. Ridgway; K. A. Woerpel. Transmetalation of Alkylboranes to Palladium in the Suzuki Coupling Reaction Proceeds with Retention of Stereochemistry. The Journal of Organic Chemistry. 1998, s. 458–460. doi:10.1021/jo970803d. PMID 11672033.
- ↑ Science of Synthesis: Best methods. Best results – Thieme Chemistry [online]. [cit. 2021-04-14]. Dostupné online.
- ↑ Matthew N. Hopkinson; Christian Richter; Michael Schedler; Frank Glorius. An overview of N-heterocyclic carbenes. Nature. 2014, s. 485–496. Dostupné online. ISSN 1476-4687. doi:10.1038/nature13384. PMID 11672033.
- ↑ a b Albert L. Casalnuovo; Calabrese. Palladium-catalyzed alkylations in aqueous media. Journal of the American Chemical Society. 1990, s. 4324–4330. doi:10.1021/ja00167a032.
- ↑ Jan H. Kirchhoff; Matthew R. Netherton; Ivory D. Hills; Gregory C. Fu. Boronic Acids: New Coupling Partners in Room-Temperature Suzuki Reactions of Alkyl Bromides. Crystallographic Characterization of an Oxidative-Addition Adduct Generated under Remarkably Mild Conditions. Journal of the American Chemical Society. 2002, s. 13662–13663. doi:10.1021/ja0283899. PMID 12431081.
- ↑ Atsushi Ohtaka. Recyclable Polymer-Supported Nanometal Catalysts in Water. The Chemical Record. 2013, s. 274–285. doi:10.1002/tcr.201300001. PMID 23568378.
- ↑ R. Martin; S. L. Buchwald. Palladium-Catalyzed Suzuki−Miyaura Cross-Coupling Reactions Employing Dialkylbiaryl Phosphine Ligands. Accounts of Chemical Research. 2008, s. 1461–1473. doi:10.1021/ar800036s. PMID 18620434.
- ↑ a b ROUHI, A. Maureen. Fine Chemicals. C&EN. 6 September 2004.
- ↑ JACKS1, Thomas E.; BELMONT, Daniel T.; BRIGGS, Christopher A.; HORNE, Nicole M.; KANTER, Gerald D.; KARRICK, Greg L.; KRIKKE, James J. Development of a Scalable Process for CI-1034, an Endothelin Antagonist. Organic Process Research & Development. 1 March 2004, s. 201–212. doi:10.1021/op034104g.
- ↑ Zupeng Chen, Evgeniya Vorobyeva, Sharon Mitchell, Edvin Fako, Manuel A. Ortuño, Núria López, Sean M. Collins, Paul A. Midgley, Sylvia Richard, Gianvito Vilé, Javier Pérez-Ramírez. A heterogeneous single-atom palladium catalyst surpassing homogeneous systems for Suzuki coupling. Nature Nanotechnology. 2018, s. 702–707. Dostupné online. doi:10.1038/s41565-018-0167-2. PMID 29941887.
- ↑ Aaron Balog; Dongfang Meng; Ted Kamenecka; Peter Bertinato; Dai-Shi Su; Erik J. Sorensen; Samuel J. Danishefsky. Total Synthesis of(–)-Epothilone A. Angewandte Chemie International Edition in English. 1996, s. 2801–2803. doi:10.1002/anie.199628011.
- ↑ Junjia Liu; Stephen D. Lotesta; Erik J. Sorensen. A concise synthesis of the molecular framework of pleuromutilin. Chemical Communications. 2011, s. 1500–1502. doi:10.1039/C0CC04077K. PMID 21079876.
- ↑ J. R. Vyvyan; Emily A. Peterson; Mari L. Stephan. An expedient total synthesis of (+/−)-caparratriene. Tetrahedron Letters. 1999, s. 4947–4949. doi:10.1016/S0040-4039(99)00865-5. PMID 21079876.
- ↑ a b c d Fu-She Han. Transition-metal-catalyzed Suzuki–Miyaura cross-coupling reactions: a remarkable advance from palladium to nickel catalysts. Chemical Society Reviews. 2013-01-01, s. 5270–5298. doi:10.1039/c3cs35521g. PMID 23460083.
- ↑ Virgil Percec; Jin-Young Bae; Dale Hill. Aryl Mesylates in Metal Catalyzed Homocoupling and Cross-Coupling Reactions. 2. Suzuki-Type Nickel-Catalyzed Cross-Coupling of Aryl Arenesulfonates and Aryl Mesylates with Arylboronic Acids. Journal of Organic Chemistry. 1995, s. 1060–1065. doi:10.1021/jo00109a044.
- ↑ Kaoru Inada; Norio Miyaura. Synthesis of Biaryls via Cross-Coupling Reaction of Arylboronic Acids with Aryl Chlorides Catalyzed by NiCl2/Triphenylphosphine Complexes. Tetrahedron. 2000, s. 8657–8660. doi:10.1016/S0040-4020(00)00814-0.
- ↑ Yu-Long Zhao; You Li; Shui-Ming Li; Yi-Guo Zhou; Feng-Yi Sun; Lian-Xun Gao; Fu-She Han. A Highly Practical and Reliable Nickel Catalyst for Suzuki-Miyaura Coupling of Aryl Halides. Advanced Synthesis & Catalysis. 2011-06-01, s. 1543–1550. doi:10.1002/adsc.201100101.
- ↑ Lei Wu; Jie Ling; Zong-Quan Wu. A Highly Active and Recyclable Catalyst: Phosphine Dendrimer-Stabilized Nickel Nanoparticles for the Suzuki Coupling Reaction. Advanced Synthesis & Catalysis. 2011-06-01, s. 1452–1456. doi:10.1002/adsc.201100134.
- ↑ C. T. Yang; Zhen-Qi Zhang; Yu-Chen Liu; Lei Liu. Copper-Catalyzed Cross-Coupling Reaction of Organoboron Compounds with Primary Alkyl Halides and Pseudohalides. Angewandte Chemie International Edition. 2011, s. 3904–3907. doi:10.1002/anie.201008007. PMID 21455914.
- ↑ R. B. Bredford; Mark A. Hall; George R. Hodges; Michael Huwe; Mark C. Wilkinson. Simple mixed Fe–Zn catalysts for the Suzuki couplings of tetraarylborates with benzyl halides and 2-halopyridines. Chemical Communications. 2009, s. 6430–6432. doi:10.1039/B915945B. PMID 19841799.
- ↑ M. Nakamura; Toru Hashimoto; Kalum K. A. D. S. Kathriarachchi; Takeshi Zenmyo; Hirofumi Seike; Masaharu Nakamura. Iron-Catalyzed Alkyl-Alkyl Suzuki-Miyaura Coupling. Angewandte Chemie International Edition. 2012, s. 8834–8883. doi:10.1002/anie.201202797. PMID 22848024.
- ↑ Y. Na; Soyoung Park; Soo Bong Han; Hoon Han; Sangwon Ko; Sukbok Chang. Ruthenium-Catalyzed Heck-Type Olefination and Suzuki Coupling Reactions: Studies on the Nature of Catalytic Species. Journal of the American Chemical Society. 2004, s. 250–258. doi:10.1021/ja038742q. PMID 14709090.
- ↑ a b Nicholas A. Weires; Emma L. Baker; Neil K. Garg. Nickel-catalysed Suzuki–Miyaura coupling of amides. Nature Chemistry. 2015, s. 75–79. doi:10.1038/nchem.2388. PMID 26673267.
- ↑ Gary A. Molander; Betina Biolatto. Palladium-Catalyzed Suzuki−Miyaura Cross-Coupling Reactions of Potassium Aryl- and Heteroaryltrifluoroborates. Journal of Organic Chemistry. 2003, s. 4302–4314. doi:10.1021/jo0342368. PMID 12762730.
- ↑ Roderick Bates. Organic Synthesis Using Transition Metals. [s.l.]: Wiley, 2012. ISBN 978-1119978930.
- ↑ a b Debra Dolliver, Bijay T. Bhattarai, Arjun Pandey, Megan L. Lanier, Amber S. Bordelon, Sarju Adhikari, Jordan A. Dinser, Patrick F. Flowers, Veronica S. Wills, Caroline L. Schneider, Kevin H. Shaughnessy, Jane N. Moore, Steven M. Raders, Timothy S. Snowden, Artie S. McKim, Frank R. Fronczek. Stereospecific Suzuki, Sonogashira, and Negishi Coupling Reactions of N-Alkoxyimidoyl Iodides and Bromides. Journal of Organic Chemistry. 2013, s. 3676–3687. doi:10.1021/jo400179u. PMID 23534335.
- ↑ Andrey Asachenko; Kristina Sorochkina; Pavel Dzhevakov; Maxim Topchiy; Mikhail Nechaev. Suzuki–Miyaura Cross-Coupling under Solvent-Free Conditions. Advanced Synthesis & Catalysis. 2013, s. 3553–3557. doi:10.1002/adsc.201300741.
- ↑ Changduo Pan; Zhang Liu; Huayue Wu; Jinchang Din; Jiang Cheng. Palladium catalyzed ligand-free Suzuki cross-coupling reaction. Catalysis Communications. 2008, s. 321–323. doi:10.1016/j.catcom.2007.06.022.
- ↑ a b Adam F. Littke. Versatile Catalysts for the Suzuki Cross-Coupling of Arylboronic Acids with Aryl and Vinyl Halides and Triflates under Mild Conditions. Journal of the American Chemical Society. 2000, s. 4020–4028. doi:10.1021/ja0002058.
- ↑ Ming-Gang Hu; Song Wei; Ai-Ai Jian. Highly Efficient Pd/C-Catalyzed Suzuki Coupling Reaction of p-(un)Substituted Phenyl Halide with (p-Substituted phenyl) Boronic Acid. Chinese Journal of Chemistry. 2007, s. 1183–1186. doi:10.1002/cjoc.200790220.
- ↑ B. Saito. Alkyl−Alkyl Suzuki Cross-Couplings of Unactivated Secondary Alkyl Halides at Room Temperature. Journal of the American Chemical Society. 2007, s. 9602–9603. doi:10.1021/ja074008l. PMID 17628067.
- ↑ J. V. Kingston; John G. Verkade. Synthesis and Characterization of R2PNP(iBuNCH2CH2)3N: A New Bulky Electron-Rich Phosphine for Efficient Pd-Assisted Suzuki−Miyaura Cross-Coupling Reactions. Journal of Organic Chemistry. 2007, s. 2816–2822. doi:10.1021/jo062452l. PMID 17378611.
- ↑ C. Baillie; Lixin Zhang; Jianliang Xiao. Ferrocenyl Monophosphine Ligands: Synthesis and Applications in the Suzuki−Miyaura Coupling of Aryl Chlorides. Journal of Organic Chemistry. 2004, s. 7779–7782. doi:10.1021/jo048963u. PMID 15498017.
- ↑ J. Han; Y. Liu; R. Guo. Facile synthesis of highly stable gold nanoparticles and their unexpected excellent catalytic activity for Suzuki-Miyaura cross-coupling reaction in water. Journal of the American Chemical Society. 2009, s. 2060–2061. doi:10.1021/ja808935n. PMID 19170490.
- ↑ B. H. Lipshutz; Tue B. Petersen; Alexander R. Abela. Room-Temperature Suzuki−Miyaura Couplings in Water Facilitated by Nonionic Amphiphiles. Organic Letters. 2008, s. 1333–1336. doi:10.1021/ol702714y. PMID 18335944.
Média použitá na této stránce
Autor: Organic Chemist 19, Licence: CC BY-SA 3.0
CisTransPalladiumComplex
Autor: Protenz, Licence: CC BY-SA 4.0
Suzuki-Miyaura synthesis of an antiproliferative agent
Autor: Organic Chemist 19, Licence: CC BY-SA 3.0
Suzuki Coupling Full Mechanism 2
Autor: Organic Chemist 19, Licence: CC BY-SA 3.0
CNS Intermediate Synthesis Suzuki
Autor: Tyrooooone, Licence: CC BY-SA 3.0
Reaction scheme of suzuki coupling reaction to form capparatriene
Autor: Protenz, Licence: CC BY-SA 4.0
Suzuki-Miyaura coupling amides
Autor: Organic Chemist 19, Licence: CC BY-SA 3.0
Suzuki Coupling Oxidative Addition
Autor: Organic Chemist 19, Licence: CC BY-SA 3.0
Suzuki Double Bond Three
Autor: Organic Chemist 19, Licence: CC BY-SA 3.0
Suzuki Coupling Transmetalation
Autor: Organic Chemist 19, Licence: CC BY-SA 3.0
Suzuki Coupling Reductive Elimination














