Swernova oxidace
Swernova oxidace je reakce, při níž se primární nebo sekundární alkohol oxiduje na aldehyd nebo keton za použití oxalylchloridu, dimethylsulfoxidu (DMSO) a organické zásady, například triethylaminu.[1][2][3] Reakce je známa díky přípustnosti přítomnosti mnoha různých funkčních skupin.[4][5][6][7]

Vedlejšími produkty jsou dimethylsulfid H3CSCH3, oxid uhelnatý CO, oxid uhličitý CO2 a - pokud je jako zásada použit triethylamin - triethylamoniumchlorid (CH3CH2)3NHCl. Dimethylsulfid má silný zápach a oxid uhelnatý je značně toxický, takže je třeba reakci provádět v digestoři. Dimethylsulfid je těkavá kapalina, s teplotou varu 37 °C, která se při vyšších koncentracích vyznačuje nepříjemným pachem.[8][9][10]
Mechanismus
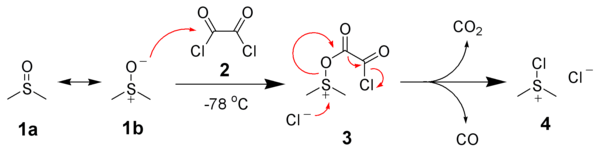
Swernova oxidace začíná reakcí dimethylsulfidu ,1a, ve skutečnosti se vyskytujícím v podobě rezonanční struktury 1b, s oxalylchloridem 2. První meziprodukt 3 se rychle rozkládá, přičemž předává uhlíkový atom oxidu uhličitému a oxidu uhelnatému za vzniku chlor(dimethyl)sulfoniumchloridu 4.
Po přidání alkoholu 5 chlor(dimethyl)sulfoniumchlorid 4 reaguje s alkoholem za tvorby meziproduktu obsahujícího alkoxysulfoniový iont, 6. Přidání nejméně dvou ekvivalentů zásady, tou je nejčastěji triethylamin, vede k deprotonaci alkoxysulfoniového iontu, čímž vzniká ylid 7. Tento ylid se, přes meziprodukt s pětičlenným cyklem, přemění na dimethylsulfid a výslednou karbonylovou slučeninu 8.

Varianty
Při pužití oxalylchloridu jako dehydratačního činidla je třeba udržovat teplotu reakční směsi pod −60 °C, aby nedošlo k vedlejším reakcím. Při použití trichlortriazinu[11] nebo anhydridu kyseliny trifluoroctové místo oxalylchloridu stačí chlazení na −30 °C. Dalšími způsoby aktivace dimethylsulfidu k zahájení tvorby meziproduktu 6 jsou použití karbodiimidů (Pfitznerova–Moffattova oxidace), acetanhydridu (Albrightova-Goldmanova oxidace) nebo komplexu oxidu sírového s pyridinem. Meziprodukt 4 lze rovněž připravit z dimethylsulfidu a N-chlorosuccinimidu (tento proces se nazývá Coreyova–Kimova oxidace).
V některých případech vede použití triethylaminu jako zásady k epimerizaci na alfa uhlíku nově vytvořené karbonylové sloučeniny. Za použití zásad s většími molekulami, například diisopropylethylaminu, lze tuto vedlejší reakci omezit.
Reference
V tomto článku byl použit překlad textu z článku Swern oxidation na anglické Wikipedii.
- ↑ Omura, K.; Swern, D.. Oxidation of alcohols by "activated" dimethyl sulfoxide. A preparative, steric and mechanistic study. Tetrahedron. 1978, s. 1651–1660. DOI 10.1016/0040-4020(78)80197-5. (anglicky)
- ↑ Mancuso, A. J.; Brownfain, D. S.; Swern, D.. Structure of the dimethyl sulfoxide-oxalyl chloride reaction product. Oxidation of heteroaromatic and diverse alcohols to carbonyl compounds. J. Org. Chem.. 1979, s. 4148–4150. DOI 10.1021/jo01337a028. (anglicky)
- ↑ Mancuso, A. J.; Huang, S.-L.; Swern, D.. Oxidation of long-chain and related alcohols to carbonyls by dimethyl sulfoxide "activated" by oxalyl chloride. J. Org. Chem.. 1978, s. 2480–2482. DOI 10.1021/jo00406a041. (anglicky)
- ↑ DONDONI, A.; PERRONE, D. Synthesis of 1,1-Dimethyl Ethyl-(S)-4-formyl-2,2-dimethyl-3-oxazolidinecarboxylate by Oxidation of the Alcohol. Org. Synth.. 2004. Dostupné online. (anglicky); Coll. Vol.. S. 320. (anglicky)
- ↑ BISHOP, R. 9-Thiabicyclo[3.3.1]nonane-2,6-dione. Org. Synth.. 1998. Dostupné online. (anglicky); Coll. Vol.. S. 692. (anglicky)
- ↑ LEOPOLD, E. J. Selective hydroboration of a 1,3,7-triene: Homogeraniol. Org. Synth.. 1990. Dostupné online. (anglicky); Coll. Vol.. S. 258. (anglicky)
- ↑ Tojo, G.; FERNÁNDEZ, M. Oxidation of alcohols to aldehydes and ketones: A guide to current common practice. [s.l.]: Springer, 2006. ISBN 0-387-23607-4. (anglicky)
- ↑ Mancuso, A. J.; Swern, D.. Activated dimethyl sulfoxide: Useful reagents for synthesis. Synthesis. 1981, s. 165–185. DOI 10.1055/s-1981-29377. (anglicky)
- ↑ Tidwell, T. T. Oxidation of alcohols to carbonyl compounds via alkoxysulfonium ylides: The Moffatt, Swern, and related oxidations. Org. React.. 1990, s. 297–572. DOI 10.1002/0471264180.or039.03. (anglicky)
- ↑ Tidwell, T. T. Oxidation of alcohols by activated dimethyl sulfoxide and related reactions: An update. Synthesis. 1990, s. 857–870. DOI 10.1055/s-1990-27036. (anglicky)
- ↑ De Luca Lidia. A Mild and Efficient Alternative to the Classical Swern Oxidation. The Journal of Organic Chemistry. S. 7907–7909. DOI 10.1021/jo015935s. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Swernova oxidace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Swernova oxidace na Wikimedia Commons
Média použitá na této stránce
Description: Reaction scheme of the Swern reaction.
- Author, date of creation: selfmade by ~K, 15 October 2005.
- Source: -
- Copyright: Public domain. (PD)
- Comments: high-resolution b/w PNG; ChemDraw / The GIMP.
Description: Reaction mechanism of the Swern reaction.
- Author, date of creation: selfmade by ~K, 30 October 2005.
- Source: -
- Copyright: Public domain. (PD)
- Comments: high-resolution b/w PNG; ChemDraw / The GIMP.
Description: Reaction mechanism of dimethylchlorosulfonium chloride formation in the Swern reaction.
- Author, date of creation: selfmade by ~K, 30 October 2005.
- Source: -
- Copyright: Public domain. (PD)
- Comments: high-resolution b/w PNG; ChemDraw / The GIMP.


