Synapse
Synapse je spojení dvou neuronů (nebo smyslové buňky a neuronu), sloužící k předávání vzruchů. V dnešní době[kdy?] je považována za „jednotku“ aktivity mozku namísto neuronu.
K synapsi dochází chemicky (což je častější způsob v centrální nervové soustavě, se zpožděním cca 1ms) anebo elektricky (gap junction), což vede k rychlé synchronizaci a koordinaci neuronální aktivity, a synapse tvoří konexony složené z konexinů, tj. pórů umožňujících tok náboje.
Úvod

Mozek člověka obsahuje stovky miliard buněk (nervových a gliových) a ke každé nervové buňce (neuronu) přísluší 20–1000 synapsí. V dnešní době je ve výpočetní neurovědě považována synapse za „jednotku“ mozku. Lidský mozek obsahuje těchto synapsí pravděpodobně triliony.[1] Nové výzkumy ukazují, že odvozená kapacita je větší než petabajt.[2] Ovšem využívaná struktura může být mnohem jednodušší.[3] Jako synapsi označujeme část buněčného obalu neuronu, který vydává neurotransmiter, synaptickou štěrbinu a část buněčného obalu neuronu, která obsahuje receptory, které na sebe vážou neurotransmitery.
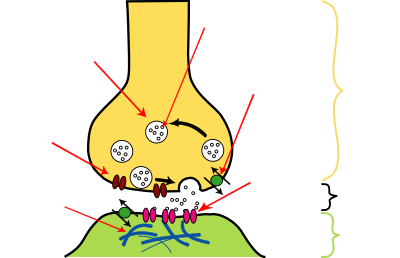
Elektrický signál (neboli akční potenciál) putuje z těla neuronu přes axon (potažený myelinovou pochvou) k terminálům, což jsou místa kontaktu s dendrity. Zde dochází k přenosu informace na jiný neuron pomocí synaptické štěrbiny. Poté, co k ní doputuje akční potenciál, tak se uvolní chemické látky (neurotransmitery), které putují synaptickou štěrbinou a na druhé straně se navážou na receptory (specializované molekuly), aktivují se postsynaptické receptory a dojde k vytvoření postsynaptického potenciálu. Poté, co dojde k vytvoření dostatečného množství těchto postsynaptických potenciálů (a jejich součet překročí kritickou mez), je vytvořen nový akční potenciál, který putuje k dalšímu neuronu.[4]
Převod vzruchu
Synapse nepřivádějí informaci pouze jedním směrem, nicméně kvůli refrakterní době je převod signálu zpět znemožněn. Zpoždění převodu informace je přibližně 0,5–25 ms. Nedochází k převodu jednotlivých vzruchů, ale k přenosu dojde vždy až po sečtení vzruchů z několika axonů (prostorová sumace) či po sečtení vzruchů z jednoho axonu, které následují rychle po sobě (časová sumace). Vedení vzruchu může navíc ulehčit tzv. facilitace, kdy vzruchy převedené některými axony ulehčí převod vzruchu z dalšího neuronu.[5]
Mechanismus převodu vzruchu
K převodu nedochází elektricky (přestože je iniciátorem elektrický signál), ale látkově. Do synaptické štěrbiny se uvolňují mediátory (chemické látky, neurotransmitery), které způsobí změnu permeability membrány. Následně dochází k depolarizaci a buď k excitaci synapse (převede vzruch) či k inhibici synapse (hyperpolarizace a nepřevedení vzruchu). Účinkem mediátorů (neurotransmiterů) tedy vznikají excitační či inhibiční potenciály. Tyto potenciály se následně sčítají a dle toho, zda převáží inhibiční či excitační vzruchy, dochází k centrálnímu podráždění či útlumu.[5] Stabilizačními elementy jsou transsynaptické proteinové komplexy (neurexin/neuroligin, cadheriny, ephrinB) a perineuronální sítě.
Chemická synapse
Celkem je v mozku cca 100 bilionů synapsí a neuronů okolo 86 miliard, tj. průměrný neuron v kůře má několik tisíc synaptických vstupů s extrémem Purkyňovy buňky mozečku s cca 200 000 synapsemi, často obalena nasedajícím výběžkem astrocytu (tripartitní synapse). Neurony se v synapsích přímo nedotýkají, je mezi nimi mezera (synaptická štěrbina) o šířce asi 20-40 nm. Spojení se uskutečňují mezi nervovými zakončeními jednoho neuronu a vstupní membránou dalšího neuronu. Jako vstupní membránu označujeme membránu dendritů a buněčného těla neuronu.
Jestliže přijde po nervovém vlákně určitého neuronu k nervovému zakončení signál v podobě akčního potenciálu, který můžeme označit jako signál elektrický, nepřejde ve stejné podobě na další neuron, ale přenese se na další neuron v podobě signálu chemického: z nervového zakončení se vyloučí chemická látka – neurotransmiter, která způsobí vznik synaptického potenciálu na dalším neuronu. (Po „vylití“ do synaptické štěrbiny se molekuly neurotransmiteru vážou na receptory v synaptické membráně následného neuronu. Zde vyvolávají malé změny propustnosti membrány pro ionty sodíku.)
Části synapse
- presynaptický terminál – slouží k uvolnění a následné zpětné vychytávání neurotransmiterů
- synaptická štěrbina – umožňuje difúzi uvolněného neurotransmiteru, šířka 20-40 nm, synaptické zpoždění cca 1ms
- postsynaptická část – tvoří receptory aktivované transmiterem
presynaptický terminál
Presynaptický terminál zajišťuje uvolnění transmiteru v návaznosti na depolarizaci a je složen z vezikul s neurotransmitery, u glutamátu v jedné vazikule 3000 – 20 000 molekul, obsahuje aparát pro Ca2+-dependentní uvolnění transmiterů a podpůrné proteiny (cytoskelet, enzymy), mitochondrie (metabolické funkce pokrývající energetickou náročnost synaptického přenosu a také syntéza některých transmiterů), transportéry pro zpětné vychytávání (reuptake) transmiterů a presynaptické receptory (zpětnovazebná regulace). Presynaptický terminál obsahuje v průměru cca 300 vezikul naplněných transmitery, ovšem pouze část dostupná k okamžitému uvolnění (readily releasable pool vs. reserve pool) a vezikulární fúze (uvolnění kvanta transmiterů,), tj. kvantový synaptický přenos, nekvantový je méně častý a méně významný. K vlastnímu uvolnění transmiteru dochází v tzv. aktivní zóně, způsobené depolarizací membrány a otevřením napěťově řízených vápníkových kanálů (N-type a P/Q-type). Kalcium-dependentní fúze vezikuly s membránou a exocytóza neurotransmiteru do synaptické štěrbiny
Vezikulární cyklus obsahuje tyto fáze
- uptake – Vezikulární transportéry jsou naplněny neurotransmitery
- docking – přesun do aktivního zóny a uchycení k membráně, změna reserve pool na readily releasable pool, regulováno synapsiny (hlavně synapsin II), synapsiny po kalcium-dependentní fosforylaci (v návaznosti na synaptickou aktivitu) uvolňují vezikuly z rezervního poolu
- priming – příprava vezikulu na fúzi (ATP-dependentní), regulováno komplexem Rab3a/RIM-Munc13 a prostorově asociováno s vápníkovými kanály
- fusion a exocytóza – otevření napěťově-řízených vápníkových kanálů vede k fúzi a uvolněné, vznik SNARE komplexu
recyklace vezikul, dva režimy interakce vezikulu s presynaptickou membránou (exocytózy), kiss-and-go (kiss-and-run), tj. vytvoření transientního fúzního póru, uvolnění pouze části vezikulárního obsahu a recyklace vezikulu (častější, závislost na presynaptické koncentraci kalcia a nejen z pohledu vezikul chytřejší způsob interakce než druhý způsob, kiss-and-stay , tj. fúze vezikuly s membránou a uvolnění celého obsahu. SNARE proteiny realizují fúzi vezikuly s membránou (SNARE = soluble NSF-attachment protein (bez vztahu ke SNAP-25), NSF = n-ethylmaleimide sensitive fusion protein, interagují mezi sebou prostřednictvím SNARE motivů (sekvence 60 aminokyselin a tvoří SNARE komplex
- v-SNARE (R-SNARE) – vesicular SNARE, nověji R-SNARE (R=arginin), obsahuje synaptobrevin (VAMP)
- t-SNARE (Q-SNARE) – target SNARE, nověji Q-SNARE (Q=glutamin)m obsahuje syntaxin a SNAP-25
- další proteiny asociované se SNARE komplexem
- Munc18 – patří mezi SM proteiny a váže se na syntaxin pro regulace fúze
- Synaptotagmin – vezikulární vápníkový senzor pro iniciace fúze
- Synaptophysin – vazba na synaptobrevin, funkce nejasná
- Synucleiny – vazba na SNARE je mechanismem interference botulotoxinu a tetanotoxinu se synaptickou transmisí
- endocytóza – clathrin-coated pits a endosomální budding
postsynaptická část
Postsynaptická organizace je komplexnější u excitačních synapsí, tzv. postsynaptická denzita. Postsynaptické receptory nejsou distribuovány rovnoměrně, ale v clusterech, na excitačních synapsích je cca 15–100 AMPARs a 2–30 NMDARs a jedním kvantem glutamátu aktivováno v průměru 20 AMPARs a 3 NMDARs
- proteiny organizující a regulující receptory (SAPs = synapse associated proteins)
- scaffold proteiny slouží pro prostorová organizace a stabilizace, prostorová asociace receptorů s efektorovými a regulačními proteiny, např. PSD-95 → marker excitačních synapsí, gephyrin → marker inhibičních synapsí
- kinázy a fosfatázy jsou efektory metabotropních a NMDA receptorů a regulují receptory, mají vliv na genovou expresi
- proteiny postsynaptické denzity excitačních synapsí:
- Homer, Shank a GKAP pro strukturální funkco tvorbou komplexů mezi NMDARs a metabotropními glutamátovými receptory, GKAP napojení na PSD-95, přes cortactin spojení s actinem (anchoring)
- Stargazin – spojuje AMPARs a PSD-95 a regulace traffickingu AMPARs, kromě toho je podjednotkou napěťově řízených vápníkových (L-type) kanálů, mutace stargazinu se projevuje choreiformními „stargazing“ záklony hlavy a ataxií a epileptické absence
TARP a GRIP
- TARP transmembrane AMPAR regulatory protein, GRIP = glutamate receptor interacting protein, regulují trafficking a gating AMPARs
- ErbB4 – role ve formování synapsí
Cytoskelet ovlivňuje velikost a tvar postsynaptické části synapse a dendritických trnů), dochází k aktin-dependentní remodelaci při plasticitě při napojení na scaffold proteiny. Abnormality proteinů postsynaptické zóny jsou jedním z faktorů patogeneze pervazivních vývojových poruch, autismu, např. Shank KO jako animální model autismu
Typy chemických synapsí
Morfologické dělení synapsí (podle obrazu v elektronové mikroskopii)
asymetrické (Gray type I)
- výrazná postsynaptická denzita
- široká, slaběji (asymetricky) elektrondenzní aktivní zóna
- synaptické vezikuly kulaté
- excitační (glutamátergní)
symetrické (Gray type II)
- méně vyjádřená lokální specializace a tedy i menší aktivní zóna o postsynaptická denzita (symetrické)
- oválné až oploštělé vezikuly
- inhibiční (gabaergní)
Centrální synapse, které zprostředkovávají komunikaci mezi centrální nervovou soustavou(CNS) a periferní nervovou soustavou se dělí na 3 typy:
- axodendritická synapse – synapse spojuje axon s dendrity dalšího neuronu, excitační na dendritických trnech (Gray I) A inhibiční na dendritických shaftech, nejvýznamnější u gabaergních somatostatin+ interneuronů
- axoaxonová synapse – spojuje axon přímo s axonem dalšího neuronu, chandellier cells, spíše než na presynaptickém terminálu v oblasti iniciálního segmentu axonu (veto power)
- axosomatická synapse – spojení axonu přímo s buněčným tělem dalšího neuronu, nejvýznamnější u gabaergních basket cells (parvalbumin+)
Kromě centrální synapse existuje i periferní synapse – nervosvalová ploténka
- dendro-dendritické – vzácné, výskyt např. v retině nebo glomerulech čichového bulbu
Druhým typem dělení může být dělení dle funkce synapse, v závislosti na tom, jestli dochází k dráždění (excitaci) či útlumu (inhibici) postsynaptických neuronů.[5]
- inhibiční synapse
- excitační synapse
Elektrická synapse
Synapse je tvořena dvěma přilehajícími konexinovými hemikanály (connexony) umožňující tok elektrického náboje iontů. Connexony mohou být v otevřeném nebo uzavřeném stavu a převážně pouze jednosměrná transmise. Mohou být axo-dendritické, axo-somatické, axo-axonální i dendro-dendritické, které jsou častější než u chemické synapse. Pannexiny a pannexony na rozdíl od connexonů tvoří jeden kanál namísto dvou hemikanálů.
Funkce
Elektrický přenos má oproti chemické transimisi zřejmou výhodu v rychlosti a slouží pro rychlá koordinaci a synchronizaci v neuronálních sítích, např. v inhibičním parvalbumin+ interneurony a lokální generování gamma oscilací pomocí přechodných vln synchronizované inhibice nebo CPG (central pattern generators) pro coupling neuronů pro efektivní generátorovou aktivitu (CPG u automatizovaných rytmických pohybů, např. dýchání nebo chůze). Mezi astrocyty dochází také prostorové pufrování K+ při intenzivnější neuronální aktivitě a šíření kalciových vln
Patologie
Patofofyziologické důsledky poruchy elektrických synapsí:
- Cx-36 a 43 – epilepsie, tj. porucha synchronizace neuronální aktivity, hypersynchronní oscilace
- Cx-32 a 47 – poruchy myelinizace (dysmyelinizace a demyelinizace), přítomné v oligodendrocytech a Schwannových buňkách, dysfunkce jednou z příčin Charcot-Marie-Tooth disease (periferní porucha myelinizace)
- Cx-26 – kongenitální porucha sluchu (exprimován ve vláskových buňkách)
Odkazy
Reference
- ↑ KOUKOLÍK, František. Mozek a jeho duše. třetí. vyd. Praha: Galén, 2005. 263 s. ISBN 80-7262-314-1.
- ↑ Memory capacity of brain is 10 times more than previously thought. medicalxpress.com [online]. 2016-01-20 [cit. 2022-01-28]. Dostupné online. (anglicky)
- ↑ The brain learns completely differently than we've assumed since the 20th century. medicalxpress.com [online]. 2018-03-23 [cit. 2022-01-28]. Dostupné online. (anglicky)
- ↑ GOLDBERG, Elkhonon. Jak nás mozek civilizuje. Praha: Karolinum, 2004. 257 s. ISBN 80-246-0713-1. S. 44.
- ↑ a b c SELIGER, Václav. Fyziologie člověka. Praha: SPN, 1983. 432 s. 14-612-83.
Literatura
- SELIGER, Václav. Fyziologie člověka. Praha: SPN, 1983. 432 s. 14-612-83.
- KOUKOLÍK, František. Mozek a jeho duše. třetí. vyd. Praha: Galén, 2005. 263 s. ISBN 80-7262-314-1.
- GOLDBERG, Elkhonon. Jak nás mozek civilizuje. Praha: Karolinum, 2004. 257 s. ISBN 80-246-0713-1. S. 44.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu synapse na Wikimedia Commons
Obrázky, zvuky či videa k tématu synapse na Wikimedia Commons
Média použitá na této stránce
Drawing illustrating the process of synaptic transmission in neurons, cropped from original in an NIA brochure.
Autor:
- Synapse_Illustration2_tweaked.svg: Nrets
- derivative work: Looie496 (talk)
Synapse illustration without labels, intended for use in constructing an html map