TEMPO
| TEMPO | |
|---|---|
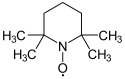
 Strukturní vzorec | |
 Vzhled | |
| Obecné | |
| Systematický název | (2,2,6,6-tetramethylpiperidin-1-yl)oxyl |
| Ostatní názvy | (2,2,6,6-tetramethylpiperidin-1-yl)oxidanyl |
| Sumární vzorec | C9H18NO |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 2564-83-2 |
| EC-no (EINECS/ELINCS/NLP) | 219-888-8 |
| PubChem | 2724126 |
| ChEBI | 32849 |
| SMILES | CC1(CCCC(N1[O])(C)C)C |
| InChI | 1S/C9H18NO/c1-8(2)6-5-7-9(3,4)10(8)11/h5-7H2,1-4H3 |
| Vlastnosti | |
| Molární hmotnost | 156,25 g/mol |
| Teplota tání | 36 až 38 °C (309 až 311 K) |
| Bezpečnost | |
| H-věty | H314[1] |
| P-věty | P260 P264 P273 P280 P301+330+331 P303+361+353 P304+340 P305+351+338 P310 P321 P363 P405 P501 |
Některá data mohou pocházet z datové položky. | |
(2,2,6,6-tetramethylpiperidin-1-yl)oxyl neboli (2,2,6,6-tetramethylpiperidin-1-yl)oxidanyl, zkráceně TEMPO, je organická sloučenina se vzorcem (CH2)3(CMe2)2NO. Jedná se o červenooranžovou pevnou látku, která může sublimovat. Jde o stabilní aminoxylový radikál, s využitím v chemii a biochemii.[2]
TEMPO se používá při zkoumání biologických systémů. kde se spojuje s elektronovou paramagnetickou rezonancí, jako činidlo v organické syntéze a v radikálových polymerizacích.[3]
Příprava
TEMPO se připravuje oxidací 2,2,6,6-tetramethylpiperidinu.
Struktura

Struktura TEMPO byla určena rentgenovou krystalografií. Čtveřice methylových skupin radikál chrání.
Stabilitu radikálu způsobuje delokalizace radikálu, která vytváří mezi atomy N a O tříelektronovou vazbu. Stabilizace je podobná jako u oxidu dusnatého a dusného. Další stabilitu vytváří sterické efekty čtveřice methylových skupin navázaných na aminoxyl. Tyto methyly jsou inertními substituenty, zatímco každé methinové (CH) centrum vedle aminoxylu by jím bylo odštěpováno.[5]
Bez ohledu na příčiny stability radikálu jsou vazby O–H u hydrogenovaného derivátu (hydroxylaminové sloučeniny, 1-hydroxy-2,2,6,6-tetramethylpiperidinu) TEMPO–H slabé; s disociačními energiemi kolem 290 kJ/mol} asi o 30 % slabší než obvyklá vazba O–H.[6]
Použití v organické syntéze
TEMPO se používá v organické syntéze jako katalyzátor oxidací primárních alkoholů na aldehydy; aktivním oxidantem je zde N-oxoamonná sůl; vzniklá při použití chlornanu sodného jako stechiometrického oxidačního činidla reakcí kyseliny chlorné s TEMPO.

Jako příklad může sloužit oxidace (S)-(−)-2-methyl-butan-1-olu na (S)-(+)-2-methylbutanal:[7] 4-methoxyfenethylalkohol se může oxidovat na příslušnou karboxylovou kyselinu systémem obsahujícím katalytické množství TEMPO a chlornanu sodného a stechiometrický chloritan sodný.[8] Oxidace pomocí TEMPO jsou chemoselektivní, protože nepůsobí na sekundární alkoholy, ale mohou převádět aldehydy na karboxylové kyseliny.
Sekundární alkoholy se pomocí TEMPO lépe oxidují v kyselém prostředí, protože pak snadněji poskytují vodíkové ionty.[9]
Když sekundární oxidační činidla vyvolávají vedlejší reakce, tak lze TEMPO stechiometricky přeměnit na oxoamonnou sůl, například při oxidaci geraniolu na geranial se nejprve oxiduje 4-acetamido-TEMPO na tetrafluorboritan oxoamonia.[10]
TEMPO je možné zapojit i do nitroxidových radikálových polymerizací (NMP), což jsou řízené radikálové polymerizace umožňující ovládat rozdělení molekulových hmotností produktů. TEMPO se může navázat na konec rostoucího řetězce polymeru, čímž vytvoří „spící“ řetězec a zastaví polymerizaci. Vazba mezi TEMPO a polymerním řetězcem je ovšem slabá a může být narušena, například zahřátím, čímž lze polymerizaci znovu spustit. Je tak možné řídit míru polymerizace a získat řetězce s úzkým rozdělením.
Použití v průmyslu a analogy
TEMPO je dostatečně levné, aby se dalo používat v laboratořích.[11] Existují i průmyslové procesy, do kterých se TEMPO zapojuje.[12]
Jsou známy i další sloučeniny s podobnou strukturou, převážně založené na 4-hydroxy-TEMPO (TEMPOL). Tato sloučenina se získává z acetonu a amoniaku přes triacetonamin, čímž se snižuje nákladnost. K dalším alternativám patří komplexy TEMPO s polymery, ty jsou recyklovatelné.[13]
K příkladům využití TEMPO a podobných sloučenin v průmyslu patří mimo jiné stabilizátory aminů a inhibitory polymerizace.
Odkazy
Související články
- 1-hydroxy-2,2,6,6-tetramethylpiperidin, redukovaný derivát TEMPO
- 4-hydroxy-TEMPO
- N
Externí odkazy
 Obrázky, zvuky či videa k tématu TEMPO na Wikimedia Commons
Obrázky, zvuky či videa k tématu TEMPO na Wikimedia Commons - TEMPO
Reference
V tomto článku byl použit překlad textu z článku TEMPO na anglické Wikipedii.
- ↑ a b https://pubchem.ncbi.nlm.nih.gov/compound/15337
- ↑ S. Barriga. 2,2,6,6-Tetramethylpiperidine-1-oxyl (TEMPO). Synlett. 2001, s. 563. Dostupné online. DOI 10.1055/s-2001-12332.
- ↑ F. Montanari; S. Quici; H. Henry-Riyad; T. T. Tidwell. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: John Wiley & Sons, 2005. ISBN 0471936235. DOI 10.1002/047084289X.rt069.pub2.
- ↑ Yonekuta Yasunori; Oyaizu Kenichi; Nishide Hiroyuki. Structural Implication of Oxoammonium Cations for Reversible Organic One-electron Redox Reaction to Nitroxide Radicals. Chemical Letters. 2007. DOI 10.1246/cl.2007.866.
- ↑ A. L. Zanocco; A. Y. Canetem; M. X. Melendez. A Kinetic Study of the Reaction between 2-p-methoxyphenyl-4-phenyl-2-oxazolin-5-one and 2,2,6,6-Tetramethyl-1-piperidinyl-N-oxide. Boletín de la Sociedad Chilena de Química. 2000. Dostupné online. DOI 10.4067/S0366-16442000000100016.
- ↑ C. Galli. Chemistry of Hydroxylamines, Oximes and Hydroxamic Acids. [s.l.]: John Wiley & Sons, 2009. Dostupné online. DOI isbn = 978-0-470-51261-6. Kapitola Nitroxyl radicals, s. 705–750.
- ↑ ANELLI, P. L.; MONTANARI, F.; QUICI, S. A General Synthetic Method for the Oxidation of Primary Alcohols to Aldehydes: (S)-(+)-2-Methylbutanal. Org. Synth.. 1990, s. 212. Dostupné online. (anglicky); Coll. Vol.. S. 367. (anglicky)
- ↑ ZHAO, M. M.; LI, J.; MANO, E.; SONG, Z. J.; TSCHAEN, D. M. Oxidation of Primary Alcohols to Carboxylic Acids with Sodium Chlorite catalyzed by TEMPO and Bleach: 4-Methoxyphenylacetic Acid. Org. Synth.. 2005, s. 195. Dostupné online. (anglicky)
- ↑ Detailed study about TEMPO oxidation [online]. LISKON-CHEM. Dostupné online.
- ↑ BOBBITT, J. M.; MERBOUH, N. 2,6-Octadienal, 3,7-dimethyl-, (2E)-. Org. Synth.. 2005, s. 80. Dostupné online. (anglicky)
- ↑ TEMPO [online]. Sigma-Aldrich. Dostupné online.
- ↑ TEMPO-LISKON industrial-scale [online]. Dostupné online.
- ↑ R. Ciriminna; M. Pagliaro. Industrial Oxidations with Organocatalyst TEMPO and Its Derivatives. Organic Process Research & Development. 2010. DOI 10.1021/op900059x.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Structure of 2,2,6,6-Tetramethylpiperidineoxyl (TEMPO)
Autor: Smokefoot, Licence: CC BY-SA 4.0
structure of TEMPO from doi 10.1002/mrc.1270050111
Autor: Secalinum, Licence: CC BY 3.0
Oxidations Mediated by TEMPO and Related Stable Nitroxide Radicals (Anelli Oxidation)