Takahašiova totální syntéza taxolu

Takahašiova totální syntéza taxolu je jedním ze způsobů totální syntézy taxolu; popsal ji Takaši Takahaši v roce 2006.[1] Začíná u geraniolu a od ostatních šesti postupů se liší tím, že jde o formální syntézu, kde je konečným produktem baccatin III, postrádající amidový vedlejší řetězec přítomný u samotého taxolu, a také tím, že je racemická (vzniklý baccatin III není opticky aktivní). Několik kroků (při vytváření kruhů A, B a C) bylo provedeno v automatickém syntetizátoru a automatizované bylo i přečišťování.
Syntéza kruhu A
Syntéza kruhu A začala u geraniolu 1, který byl acetylován acetanhydridem a 4-dimethylaminopyridinem v triethylaminu na sloučeninu 2, jež byla epoxidována N-bromsukcinimidem ve směsi vody a terc-butanolu a následně v triethylaminu na 3. U meziproduktu 3 proběhla radikálová cyklizace působením titanocendichloridu, manganu, triethylboranu a 2,6-lutidinu na 4, následovalo ochránění alkoholové skupiny a reakce s ethylvinyletherem a kyselinou kamforsulfonovou za vzniku 5, odstranění chránicí skupiny (NaOH, MeOH/THF/H2O) za vzniku alkoholu 6, Parikhova-Doeringova oxidace na aldehyd 7, izomerizace 1,8-diazabicykloundec-7-enem na enon 8, redukce tetrahydridoboritanem sodným na alkohol 9, ochránění alkoholu jako terc-butyldimethylsilyletheru terc v triethylaminu za vzniku sloučeniny 10, vytvoření hydrazonu 11 působením N-tosylhydrazinu a nakonec tvorba vinylbromidu 12 pomocí terc-butyllithia a 1,2-dibromethanu.
 |
| Syntéza kruhu A |
|---|
Syntéza kruhu C
K vytvoření kruhu C byl použit hydroxygeranylacetát 2. Následovala posloupnost reakcí; allylová oxidace oxidem seleničitým, terc-butylperoxidem a kyselinou salicylovou na aldehyd 13, u něj proběhla karbonylová redukce borohydridem sodným na alkohol 14, následně epoxidace vanadylacetylacetonátem a terc-butylperoxidem na 15. Takto vytvořená sloučenina byla ochráněna na alkoholové skupině jako 4-methoxyfenylmethylether (MPM ether) reakcí s MPMtrichloracetimidátem za vzniku 16, poté proběhla radikálová cyklizace pomocí titanocendichloridu, manganu, triethylboranu, trimethylsilylchloridu a uhličitanu draselného na alkohol 17, ochránění alkoholu s využitím benzylchlormethyletheru (BOMCl) a N,N-diisopropylethylaminem (DIPEA) jako benzyloxymethyletheru 18, hydrolýza acetátové skupiny roztokem hydroxidu sodného a Leyova oxidace na aldehyd 19.
 |
| Syntéza kruhu C |
|---|
Syntéza kruhu B
Kruhy A (12) a C (19) prošly vzájemnou Shapirovou reakcí za přítomnosti terc-butyllithia a chloridu ceritého za vzniku alkoholu 20 podobným způsobem jako u Nicolaouovy syntézy. Poté došlo k epoxidaci vanadylacetylacetonátem a terc-butylperoxidem za tvorby sloučeniny 21, redukci hydridem lithnohlinitým na diol a ochránění alkoholu vodným roztokem hydroxidu draselného s benzylbromidem a terc-butylamoniumsulfonátem za vzniku benzyletheru 22, u nějž byla ochráněna alkoholová skupina reakcí s chlordimethylsilylhydridem a imidazolem a po oxidaci 2,3-dichlor-5,6-dikyano-1,4-benzochinonem se utvořil dimethylsilylether 23. Pak tosylací tosylchloridem a 4-dimethylaminopyridinem vznikl mezprodukt 24, odstraněním chránicí skupiny tetra-n-butylamoniumfluoridem se vytvořil diol, opětovným navázáním trimethylsilyletherové chránicí skupiny trimethylsilyltriflátem, 2,6-lutidinem a N,N-diisopropylethylaminem vznikla sloučenina 25 Tato sloučenina prošla Leyovou oxidací na aldehyd 26, z nějž se vytvořil kyanhydrin (působením trimethylsilylkyanidu, 18-crown-6 a kyanidu draselného) a ochráněním alkoholu pomocí ethylvinyletheru a kyseliny kamforsulfonové vznikl ether 27.
 |
| Syntéza kruhu B |
|---|
Syntéza kruhu D
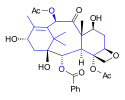
Cyklizací sloučeniny 27 alkylací bis(trimethylsilyl)amidem lithným v 1,4-dioxan za působení mikrovln se vytvořil tricyklický meziprodukt 28. Následovala hydrolýza kyanhydrinu s využitím kyseliny kamforsulfonové, oddělení trimethylsilylové chránicí skupiny roztokem hydroxidu draselného a allylová oxidace oxidem seleničitým s terc-butylperoxidem a kyselinou salicylovou na keton 29, který prošel Upjohnovou dihydroxylací za vzniku triolu 30. Triol byl acetylován acetylchloridem a 4-dimethylaminopyridinem (DMAP) a mesitylován methansulfonylchloridem s DMAP na 31, poté byly hydrogenací katalyzovanou palladiem na uhlíku odstraněny benzylová a benzyloxy skupina a vytvořil se karbonát působením trifosgenu v pyridinu za vzniku sloučeniny 32, jež byla ochráněna na sekundárním alkoholu (triethylsilylchloridem v pyridinu) a odštěpením ochrany z primárního alkoholu uhličitanem draselným se utvořil diol 33. Z tohoto diolu se vytvořil oxetan 34 působením N,N-diisopropylethylaminu a hexamethylfosforamidu, následně proběhly acetylace acetanhydridem v DMAP, benzoylace fenyllithiem na 35, oxidace terc-butoxidem draselným a benzenseleninanhydridem v tetrahydrofuranu na acyloin 36, izomerizace za přítomnosti terc-butoxidu draselného a acylace acetanhydridem a DMAP v pyridinu za tvorby sloučeniny 37, meziproduktu, který se dále zoxidoval na allylové skupině pyridiniumchlorchromátem na křemelině a octanem sodným v benzenu, po čemž proběhla oxidace ketonové skupiny borohydridem sodným a nakonec odstranění triethylsilylové chránicí skupiny solí kyseliny fluorovodíkové a pyridinu za vzniku baccatinu III (38).
 |
| Syntéza kruhu D |
|---|
Odkazy
Související články
- Totální syntéza taxolu
- Danishefského totální syntéza taxolu
- Holtonova totální syntéza taxolu
- Kuwadžimova totální syntéza taxolu
- Mukaijamova totální syntéza taxolu
- Nicolaouova totální syntéza taxolu
- Wenderova totální syntéza taxolu
Reference
V tomto článku byl použit překlad textu z článku Takahashi Taxol total synthesis na anglické Wikipedii.
Média použitá na této stránce
Autor: Dissolution, Licence: CC BY-SA 3.0
Taxol total synthesis Takahasi part 3
Autor: Dissolution, Licence: CC BY-SA 3.0
Taxol total synthesis Takahasi part 1
Autor: Dissolution, Licence: CC BY-SA 3.0
Taxol total synthesis Takahasi part 2
Autor: Dissolution, Licence: CC BY-SA 3.0
Taxol total synthesis Takahashi part 4
Autor: Dissolution, Licence: CC BY-SA 3.0
Baccatin Takahashi overview