Tautomerie
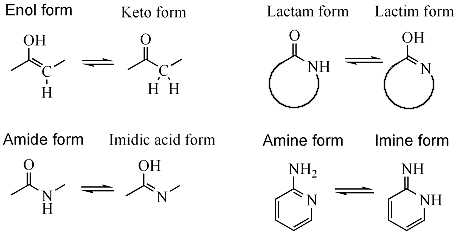
Tautomerie (též tautomerismus, z řeckého "tauto" - stejný a "meros" - část[1]) je forma izomerie organických sloučenin, kdy mohou jednotlivé izomery (nazývané zde tautomery) snadno přecházet v jiné reakcí zvanou tautomerizace.[2][3] Tato reakce běžně představuje migraci atomu vodíku či protonu, doplněná prohozením jednoduché vazby a k ní přiléhající vazby dvojné. Vzhledem k rychlému přechodu jednoho izomeru v jiný se tautomery obecně považují za totožnou sloučeninu. Tautomerie je zvláštním případem strukturní izomerie a hraje důležitou roli v nekanonickém párování bází v molekulách DNA a zejména RNA.
Chemie
V roztocích, ve kterých je možná tautomerizace, je dosaženo chemické rovnováhy (ekvilibria) tautomerů. Přesný poměr tautomerů závisí na řadě faktorů, například teplotě, rozpouštědle a pH.[4]
Mezi běžné tautomerní páry patří:
- keton – enol, např. u acetonu (viz článek keto-enol tautomerie)
- keten – ynol, např. u ethenonu
- amid – imidová kyselina, např. u hydrolýzy nitrilů
- laktam – laktim, tautomerie v heterocyklických kruzích, např. u nukleobází guaninu, thyminu a cytosinu
- enamin – imin
- enamin – enamin, například v enzymatických reakcích katalyzovaných pyridoxal-fosfátem
- anomery redukujících cukrů se v roztocích přeměňují přes formu s otevřeným řetězcem
Prototropie
Nejčastější formou tautomerie je prototropie; vyznačuje se relokací protonu.[5] Prototropní tautomerii lze považovat za podmnožinu acidobazického chování. Prototropní tautomery jsou sada izomerních protonačních stavů se stejným empirickým vzorcem a celkovým nábojem.
Tautomerizaci lze katalyzovat:
- zásadou (1. deprotonace; 2. vznik delokalizovaného aniontu, např. enolátu; 3. protonace na jiné pozici aniontu).
- kyselinou (1. protonace; 2. tvorba delokalizovaného kationtu; 3. deprotonace na jiné pozici přiléhající ke kationtu).
- Anulární tautomerie
- druh prototropní tautomerie, kde může proton zaujímat dvě nebo více pozice v heterocyklickém systému, například 1H- a 3H-imidazol; 1H-, 2H- a 4H- 1,2,4-triazol; 1H- a 2H- isoindol.[4]
- Tautomerie kruh-řetězec
- vyskytuje se tam, kde společně s přesunem protonu dochází ke změně otevřené struktury na kruh, například u otevřené a pyranové formy glukózy, resp. furanové formy fruktózy.
Valenční tautomerie
Valenční tautomerie je druhem tautomerie, kde jednoduché a/nebo dvojné vazby rychle vznikají a zanikají, aniž by docházelo k migraci atomů nebo skupin.[6] Je odlišná od prototropní tautomerie a zahrnuje procesy s rychlou reorganizací vazebných elektronů. Příkladem tohoto druhu tautomerie je bullvalen nebo otevřené a uzavřené formy některých heterocyklických sloučenin, např. azid – tetrazol či mezoiontový münchnon-acylaminoketen. Valenční tautomerie vyžaduje změnu v molekulární geometrii a neměla by se zaměňovat s kanonickými rezonančními strukturami nebo mezomery.
Reference
V tomto článku byl použit překlad textu z článku Tautomer na anglické Wikipedii.
- ↑ MCMURRY, John. Organická chemie. 6. vyd. [s.l.]: VŠCHT v Praze / VUT v Brně, 2007. ISBN 978-80-7080-637-1, ISBN 978-80-214-3291-8.
- ↑ Smith MB, March J. Advanced Organic Chemistry. 5th ed.. vyd. New York: Wiley Interscience, 2001. ISBN 0-4715-8589-0. S. 1218–1223.
- ↑ Katritzky AR, Elguero J, et al.. The Tautomerism of heterocycles. New York: Academic Press, 1976. Dostupné online. ISBN 0-1202-0651-X.
- ↑ a b Roman M. Balabin. Tautomeric equilibrium and hydrogen shifts in tetrazole and triazoles: Focal-point analysis and ab initio limit. J. Chem. Phys.. 2009, s. 154307. DOI 10.1063/1.3249968.
- ↑ IUPAC Gold Book tautomerism
- ↑ IUPAC Gold Book valence tautomerization
Externí odkazy
 Obrázky, zvuky či videa k tématu Tautomerie na Wikimedia Commons
Obrázky, zvuky či videa k tématu Tautomerie na Wikimedia Commons

