Terc-butansulfinamid
| Terc-butansulfinamid | |
|---|---|
 Strukturní vzorec R-terc-butansulfinamidu | |
 Strukturní vzorec S-terc-butansulfinamidu | |
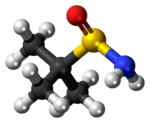 Model molekuly | |
| Obecné | |
| Systematický název | 2-methyl-2-propansulfinamid |
| Funkční vzorec | (CH3)3CS(O)NH2 |
| Sumární vzorec | C4H11SON |
| Vzhled | bílé krystaly |
| Identifikace | |
| Registrační číslo CAS | 146374-27-8 196929-78-9 (R izomer) 343338-28-3 (S izomer) |
| PubChem | 3382465 |
| SMILES | O=S(N)C(C)(C)C |
| InChI | 1S/C4H11NOS/c1-4(2,3)7(5)6/h5H2,1-3H3 |
| Vlastnosti | |
| Molární hmotnost | 121,20 g/mol |
| Teplota tání | 102 až 105 °C (375 až 378 K) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
Terc-butansulfinamid (systematický název 2-methyl-2-propansulfinamid) je organická sloučenina patřící mezi sulfinamidy, existující ve dvou enantiomerech. Tyto enantiomery se používají v asymetrické syntéze jako chirální pomocníci, často jsou chirálními ekvivalenty amoniaku při přípravě aminů.[2][3][4] Možnosti jeho využití rozpracoval v roce 1997 vědecký tým, který vedl Jonathan A. Ellman.[5]
Výroba
Čisté enantiomery terc-butansulfinamidu se vyrábějí enantioselektivní oxidací di-terc-butyldisulfidu na thiosulfinát, který následně reaguje s amidem lithným, což způsobí rozštěpení disulfidových vazeb. V původní reakci byl chirální ligand použitý společně s vanadylacetylacetonátem připraven kondenzací chirálního aminoindanolu s 3,5-di-terc-butylsalicylaldehydem.
 |
| Výroba terc-butansulfinamidu |
|---|
Reakce
Kondenzací terc-butansulfinamidu s aldehydy a ketony vznikají odpovídající N-terc-butansulfinylové aldiminy a ketiminy. Oproti ostatním iminům jsou tyto látky odolnější vůči hydrolýze, ale lépe reagují s nukleofily. Nukleofil se diastereoselektivně elektrofilně aduje na imin, přičemž terc-butansulfinyl funguje jako chránicí skupina, tu lze odstranit pomocí kyseliny chlorovodíkové za vzniku chirální soli aminu (při použití aldehydu) nebo iminu (při použití ketonu).
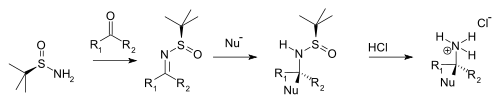 |
| Syntéza chirálního aminu z terc-butansulfinamidu |
|---|
Jako nukleofily se zde obvykle používají Grignardova činidla, enoláty a organické sloučeniny lithia nebo zinku.
K syntéze chirálních aminů lze také použít chirální sulfiniminy.[6]
Použití
Terc-butansulfinamid se používá jako chirální pomocník při asymetrické výrobě cetirizinu; výchozími látkami jsou p-chlorbenzaldehyd a fenylmagnesiumbromid:[7]
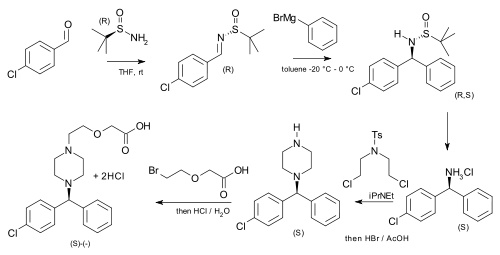 |
| Asymetrická syntéza cetirizinu |
|---|
Reference
V tomto článku byl použit překlad textu z článku tert-Butanesulfinamide na anglické Wikipedii.
- ↑ a b 2-Methylpropane-2-sulfinamide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ J. A. Ellman. Applications of tert-butanesulfinamide in the asymmetric synthesis of amines. Pure and Applied Chemistry. 2003, s. 39–46. DOI 10.1351/pac200375010039.
- ↑ Maryann T. Robak; Melissa A. Herbage; Jonathan A. Ellman. Synthesis and Applications oftert-Butanesulfinamide. Chemical Reviews. 2010, s. 3600–3740. DOI 10.1021/cr900382t. PMID 20420386.
- ↑ Organic Syntheses, Vol. 82, p.157 (2005). [1]
- ↑ Guangcheng Liu; Derek A. Cogan; Jonathan A. Ellman. Catalytic Asymmetric Synthesis oftert-Butanesulfinamide. Application to the Asymmetric Synthesis of Amines. Journal of the American Chemical Society. 1997, s. 9913. DOI 10.1021/ja972012z.
- ↑ Asymmetric Synthesis and Properties of Sulfinimines (ThiooximeS-Oxides). The Journal of Organic Chemistry. 1997, s. 2555–2563. DOI 10.1021/jo970077e. PMID 11671597.
- ↑ D. Pflum; D. Krishnamurthy; Z. Han; S. Wald; C. Senanayake. Asymmetric synthesis of cetirizine dihydrochloride. Tetrahedron Letters. 2002, s. 923. DOI 10.1016/S0040-4039(01)02294-8.
Externí odkazy
 Obrázky, zvuky či videa k tématu Terc-butansulfinamid na Wikimedia Commons
Obrázky, zvuky či videa k tématu Terc-butansulfinamid na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the tert-butanesulfinamide molecule, a compound used in organic synthesis.
Colour code:
- Carbon, C: black
- Hydrogen, H: white
- Oxygen, O: red
- Nitrogen, N: blue
- Sulfur, S: yellow
Autor: Dissolution, Licence: CC BY-SA 3.0
Asymmetric sulfinamide cetirizine synthesis
Autor: RRBinwood, Licence: CC BY-SA 4.0
(R)-Ellmans sulfinamide skeletal structure
Autor: Dissolution, Licence: CC BY-SA 3.0
Tert-butanesulfinamide_chiral_amine_synthesis
Autor: RRBinwood, Licence: CC BY-SA 4.0
(R)-Ellmans sulfinamide skeletal structure
Autor: Dissolution, Licence: CC BY-SA 3.0
Tert-butanesulfinamide_synthesis









