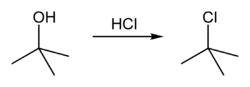
Terc-butylchlorid
| Terc-butylchlorid | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 2-chlor-2-methylpropan |
| Funkční vzorec | (CH3)3CCl |
| Sumární vzorec | C4H9Cl |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 507-20-0 |
| EC-no (EINECS/ELINCS/NLP) | 208-066-4 |
| PubChem | 10486 |
| SMILES | ClC(C)(C)C |
| InChI | 1S/C4H9Cl/c1-4(2,3)5/h1-3H3 |
| Vlastnosti | |
| Molární hmotnost | 92,567 g/mol |
| Teplota tání | −26,0 °C (247,2 K)[1] |
| Teplota varu | 50,45 °C (323,60 K)[1] |
| Rozpustnost ve vodě | málo rozpustný |
| Rozpustnost v polárních rozpouštědlech | mísitelný s ethanolem |
| Rozpustnost v nepolárních rozpouštědlech | mísitelný s diethyletherem |
| Tlak páry | 34,9 kPa (20 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H225[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P280 P303+361+353 P370+378 P403+235 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Terc-butylchlorid (systematický název 2-chlor-2-methylpropan) je organická sloučenina se vzorcem (CH3)3CCl. Tato bezbarvá hořlavá kapalina je špatně rozpustná ve vodě, kde navíc podléhá hydrolýze na terc-butanol. Používá se v organické syntéze na přípravu dalších sloučenin.[2]
Výroba a příprava
Terc-butylchlorid se vyrábí reakcí terc-butanolu s chlorovodíkem. V laboratoři jej lze připravit obdobnou reakcí s použitím koncentrované kyseliny chlorovodíkové. Tato přeměna probíhá SN1 mechanismem.
 | 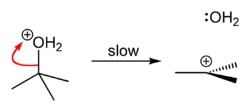 |  |
Celkově vypadá reakce takto:
Protože je terc-butanol terciárním alkoholem, tak stabilita terc-butylovéhovo karbokationtu vzniklého v druhém kroku umožňuje SN1 mechanismus, zatímco u promárního alkoholu by reakce probíhala SN2 mechanismem.
Reakce
Terc-butylchlorid rozpuštěný ve vodě podléhá hydrolýze na terc-butanol. Rozpuštěný v alkoholech vytváří příslušné terc-butylové estery.
Použití
Terc-butylchlorid se používá na výrobu antioxidantu 'terc-butylfenolu a neohexylchloridu, který je součástí některých vůní.
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Terc-butylchlorid na Wikimedia Commons
Obrázky, zvuky či videa k tématu Terc-butylchlorid na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku tert-Butyl chloride na anglické Wikipedii.
- ↑ a b c d e f 2-Chloro-2-methylpropane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ M. Rossberg et al. "Chlorinated Hydrocarbons" in Ullmann's Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a06_233.pub2
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Reaction mechanism of the nucleophilic substitution of tert-butanol by hydrogen chloride. Step 3: The chloride anion attacks the tert-butyl cation, forming tert-butyl chloride.
Skeletal formula of tert-butyl chloride, (CH3)3CCl
Reaction mechanism of the nucleophilic substitution of tert-butanol by hydrogen chloride. Step 2: Protonated tert-butanol loses H2O to form the tert-butyl cation, (CH3)3C+.
Reaction mechanism of the nucleophilic substitution of tert-butanol by hydrogen chloride. Step 1: Protonation of tert-butanol by HCl.
Reaction summary of the nucleophilic substitution of tert-butanol by hydrogen chloride
Ball-and-stick model of the tert-butyl chloride molecule, (CH3)3CCl