Tetrabrommethan
| Tetrabrommethan | |
|---|---|
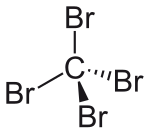 strukturní vzorec | |
 tyčinkový model molekuly | |
 kalotový model molekuly | |
| Obecné | |
| Systematický název | Tetrabrommethan |
| Ostatní názvy | bromid uhličitý |
| Funkční vzorec | CBr4 |
| Sumární vzorec | CBr4 |
| Vzhled | bezbarvá až žlutohnědá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 558-13-4 |
| PubChem | 11205 |
| ChEBI | 47875 |
| SMILES | BrC(Br)(Br)Br |
| InChI | 1S/CBr4/c2-1(3,4)5 |
| Vlastnosti | |
| Molární hmotnost | 331,63 g/mol |
| Teplota tání | 94,5 °C (367,6 K) |
| Teplota varu | 189,7 °C (462,8 K; rozklad) |
| Hustota | 3,42 g/cm3 |
| Index lomu | 1,594 2 (100 °C) |
| Kritická teplota Tk | 439 °C (712 K) |
| Kritický tlak pk | 4,26 MPa |
| Rozpustnost ve vodě | 0,024 g/100 ml (30 °C) |
| Rozpustnost v polárních rozpouštědlech | rozpustný v diethyletheru, chloroformu a ethanolu |
| Tlak páry | 5,33 kPa (96,3 °C) |
| Měrná magnetická susceptibilita | 2,826×105 μm3/g |
| Struktura | |
| Krystalová struktura | jednoklonná |
| Koordinační geometrie | tetragonální |
| Tvar molekuly | čtyřstěn |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | 26,0 až 32,8 kJ/mol |
| Standardní molární spalná entalpie ΔH°sp | −426,2 až −419,6 kJ/mol |
| Standardní molární entropie S° | 212,5 J⋅K−1⋅mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | 47,7 kJ/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H302 H315 H318 H335 |
| P-věty | P261 P280 P305 P338 P351 |
| R-věty | R38 R41 R52 R53 |
| S-věty | S26 S36 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Tetrabrommethan (podle pravidel anorganického názvosloví bromid uhličitý) je sloučenina uhlíku a bromu.
Fyzikální vlastnosti
Tetrabrommethan má dvě krystalové formy: β při teplotách pod 46,9 °C (320,0 K) a α nad touto teplotou. Energie vazby C-Br je 235 kJ/mol−1. Díky symetrickému uspořádání čtyřstěnné molekuly je jeho dipólový moment nulový. Je méně stabilní než lehčí tetrahalomethany.
Použití
CBr4 se používá v kombinaci s trifenylfosfinem v Appelově reakci, kterou se převádějí alkoholy na alkylbromidy; a také v prvním kroku Corey-Fuchsovy reakce používané pro přeměnu aldehydů na terminální alkyny (takové, kde trojná vazba vychází z koncového uhlíku).
Také se používá k rozpouštění tuků, olejů a vosků, při výrobě plastů a pryže a jako sedativum. Díky své nehořlavosti je také přidáván do ohnivzdorných směsí; po vysokou hustotu se také hodí k oddělování minerálů.
Reference
V tomto článku byl použit překlad textu z článku Tetrabromomethane na anglické Wikipedii.
- ↑ a b Carbon tetrabromide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Tetrabrommethan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Tetrabrommethan na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Natta projection of carbon tetrabromide
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances






