Tetraethylolovo
| Tetraethylolovo | |
|---|---|
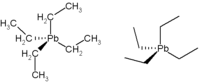 strukturní vzorec tetraethylolova | |
| Obecné | |
| Systematický název | tetraethylplumban |
| Ostatní názvy | tetraethylolovo, TEL |
| Latinský název | tetraethylplumbium |
| Anglický název | tetraethyllead |
| Německý název | Tetraethylblei |
| Funkční vzorec | (CH3CH2)4Pb |
| Sumární vzorec | C8H20Pb |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 78-00-2 |
| EC-no (EINECS/ELINCS/NLP) | 201-075-4 |
| PubChem | 6511 |
| ChEBI | 30182 |
| UN kód | 1649 |
| SMILES | CC[Pb](CC)(CC)CC |
| InChI | 1S/4C2H5.Pb/c4*1-2;/h4*1H2,2H3; |
| Číslo RTECS | TP4550000 |
| Vlastnosti | |
| Molární hmotnost | 323,44 g/mol |
| Teplota tání | −136,8 °C |
| Teplota varu | 108 °C (5,3 kPa) 82 °C (1,73 kPa) |
| Teplota rozkladu | 200 °C |
| Hustota | 1,659 g/cm³ (12 °C) 1,652 8 g/cm³ (20 °C) |
| Dynamický viskozitní koeficient | 0,87 cP (20 °C) |
| Index lomu | 1,519 8 1,519 5 (20 °C) |
| Rozpustnost ve vodě | nerozpustný |
| Rozpustnost v nepolárních rozpouštědlech | alkoholy ethery kapalné uhlovodíky |
| Povrchové napětí | 28,5 mN/m (20 °C) |
| Struktura | |
| Tvar molekuly | čtyřstěnný |
| Dipólový moment | 0 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | 52,7 kJ/mol (kapalina) 109,6 kJ/mol (plyn) |
| Entalpie varu ΔHv | 167,64 J/g |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R61 R26/27/28 R33 R50/53 R62 |
| S-věty | S53 S45 S60 S61 |
| Teplota vzplanutí | 73 °C |
Některá data mohou pocházet z datové položky. | |
Tetraethylolovo je organokovová sloučenina, která se používala jako antidetonační přísada do motorových benzínů. V dnešní době je nahrazováno ferrocenem.
Vlastnosti
Za běžných podmínek jde o bezbarvou kapalinu. Zpomaluje hoření benzínu, a proto se používalo ke zvyšování oktanového čísla automobilových benzínů. Jde o těkavou toxickou látku dobře rozpustnou v tucích, která snadno proniká kůží, ale také se rychle a prakticky úplně vstřebává ze vzduchu v plicích. V játrech se metabolizuje na toxické trietylolovo.[2]
Výroba a spalování
Slitina Na+Pb reaguje s chlorethanem za vzniku tetraethylolova, olova a chloridu sodného.
- 4 NaPb + 4 C2H5Cl → Pb(C2H5)4 + 3 Pb + 4 NaCl
Další možností výroby je působení suchého chloridu olovnatého na Grignardovo činidlo.
- 4 C2H5MgI + 2 PbCl2 → 2 MgI2 + 2 MgCl2 + Pb + Pb(C2H5)4
Tetraethylolovo se spaluje za vzniku oxidu uhličitého, vody a olova
- Pb(C2H5)4 + 13 O2 → 8 CO2 + 10 H2O + Pb
Reference
- ↑ a b Tetraethyllead. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Miroslav Šuta: Účinky výfukových plynů z automobilů na lidské zdraví, Český a Slovenský dopravní klub 1996, ISBN 80-901339-4-0
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu tetraethylolovo na Wikimedia Commons
Obrázky, zvuky či videa k tématu tetraethylolovo na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances






