Tetrahydropyran
| Tetrahydropyran | |
|---|---|
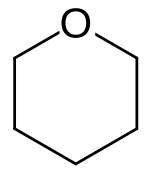 strukturní vzorec | |
 model molekuly | |
| Obecné | |
| Systematický název | oxan |
| Ostatní názvy | oxacyklohexan, THP |
| Anglický název | tetrahydropyran |
| Německý název | Tetrahydropyran |
| Sumární vzorec | C5H10O |
| Vzhled | bezbarvá těkavá kapalina |
| Identifikace | |
| Registrační číslo CAS | 142-68-7 |
| SMILES | O1CCCCC1 |
| InChI | 1S/C5H10O/c1-2-4-6-5-3-1/h1-5H2 |
| Vlastnosti | |
| Molární hmotnost | 86,13 g/mol |
| Teplota tání | −45 °C (228 K) |
| Teplota varu | 88 °C (361 K) |
| Hustota | 0,880 g/cm3 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Tetrahydropyran (THP, systematický název oxan[2]) je organická sloučenina složená z nasyceného šestičlenného cyklu, který obsahuje jeden kyslíkový a pět uhlíkových atomů. Jeho název je odvozen od pyranu, z něhož lze THP získat přidáním čtyř vodíků. Je to bezbarvá těkavá kapalina. Častěji než se samotným tetrahydropyranem se lze setkat s jeho deriváty. Tetrahydropyranylové (THP-) ethery získávané reakcí alkoholů s dihydropyranem jsou běžnými meziprodukty organické syntézy. Tetrahydropyranový kruh (pět atomů uhlíku a kyslík) je základem pyranózových sacharidů, například glukózy.
Výroba
THP se vyrábí hydrogenací (vlastně adicí vodíku) dihydropyranu (DHP) Raneyovým niklem.
Reakce
V organické syntéze se 2-tetrahydropyranylová skupina používá jako chránicí skupina pro alkoholy. Reakcí alkoholu s dihydropyranem vzniká tetrahydropyranylether, který chrání alkohol před řadou reakcí. Alkohol lze posléze snadno odstranit kyselou hydrolýzou za vzniku 5-hydroxypentanalu.
Ochrana alkoholů
Nejčastější ochranné metody
- Reakce alkoholu s dihydropyranem a kyselinou para-toluensulfonovou v dichlormethanu za pokojové teploty[3][4]
- 2-hydroxytetrahydropyranyl, trifenylfosfin a diethylazodikarboxylát v THF
Nejčastější odstranění chránicí skupiny
- Roztok kyseliny octové (AcOH) v THF nebo ve vodě
- Pyridinium p-toluensulfonát v ethanolu
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Tetrahydropyran na anglické Wikipedii.
- ↑ a b Tetrahydropyran. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ New IUPAC Organic Nomenclature - Chemical Information BULLETIN [online]. Dostupné online. (anglicky)
- ↑ WUTS, Peter G. M.; GREENE, Theodora W. Greene's Protective Groups in Organic Synthesis, Fourth Edition - Wuts - Wiley Online Library. [s.l.]: [s.n.] Dostupné v archivu pořízeném dne 2020-01-25. DOI 10.1002/0470053488. (anglicky)
- ↑ ROBINSON, Anna; AGGARWAL, Varinder K. Asymmetric Total Synthesis of Solandelactone E: Stereocontrolled Synthesis of the 2-ene-1,4-diol Core through a Lithiation–Borylation–Allylation Sequence. Angewandte Chemie International Edition. 2010-09-03, s. 6673–6675. Dostupné online. ISSN 1521-3773. DOI 10.1002/anie.201003236. (anglicky)
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Tetrahydropyran na Wikimedia Commons
Obrázky, zvuky či videa k tématu Tetrahydropyran na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
3D model of Oxane/Oxacyclohexane/Tetrahydropyrane
Chemical structure of tetrahydropyran





