Tetramethylethylendiamin
| Tetramethylethylendiamin | |
|---|---|
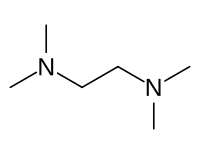 Strukturní vzorec | |
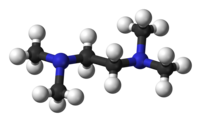 Model molekuly | |
| Obecné | |
| Systematický název | N,N,N′,N′-tetramethylethan-1,2-diamin |
| Ostatní názvy | TMEDA, TEMED |
| Funkční vzorec | (CH3)2NCH2CH2N(CH3)2 |
| Sumární vzorec | C6H16N2 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 110-18-9 |
| EC-no (EINECS/ELINCS/NLP) | 203-744-6 |
| PubChem | 8037 |
| SMILES | CN(C)CCN(C)C |
| InChI | 1/C6H16N2/c1-7(2)5-6-8(3)4/h5-6H2,1-4H3 |
| Vlastnosti | |
| Molární hmotnost | 116,20 g/mol |
| Teplota tání | −55,1 °C (218,0 K)[1] |
| Teplota varu | 121 °C (394 K)[1] |
| Hustota | 0,7765 g/cm3 (20 °C)[1] |
| Index lomu | 1,4179 (20 °C)[1] |
| Rozpustnost ve vodě | rozpustný[1] |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H225 H302 H314 H332[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P260 P261 P264 P270 P271 P280 P301+312 P301+330+331 P303+361+353 P304+312 P304+340 P305+351+338 P310 P312 P321 P330 P363 P370+378 P403+235 P405 P501[1] |
| Teplota vzplanutí | 10 °C (283 K)[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Tetramethylethylendiamin (zkráceně TMEDA nebo TEMED) je organická sloučenina se vzorcem (CH3)2NCH2CH2N(CH3)2.
Použití
Jako reaktant
TMEDA je častým ligandem kovových iontů. Tvoří stabilní komplexy s halogenidy mnoha kovů, například chloridem zinečnatým a měďným, které jsou rozpustné v organických rozpouštědlech. TMEDA zde funguje jako bidentátní ligand.
TMEDA na sebe dobře váže lithné kationty.[2] Ve směsi s n-butyllithiem se atom dusíku z této látky naváže na lithium, čímž vytvoří shluk, který je reaktivnější než obvyklý tetramer či hexamer, který n-butyllithium vytváří. Tento komplex může metalovat, někdy i dvojnásobně, řadu různých substrátů, jako jsou benzen, furan, thiofen, N-alkylpyrroly a ferrocen.[2]
Každý aniontový organokovový komplex lze izolovat ve formě [Li(tmeda)2]+ komplexu.[3] [Li(tmeda)2]+ se zde chová jako kvartérní amoniová sloučenina, jako například [N(C2H5)4]+.

Komplex trimethylethylendiaminu a bis(trimethylsilyl)amidu lithného[4]
V organické syntéze se také používá komplex trimethylethylendiaminu s s-butyllithiem. Tento komplex je vhodný v případech, kdy by n-butyllithný anion reagoval s výchozími látkami.
Ostatní použití
TEMED se používá společně s peroxodisíranem amonným jako katalyzátor polymerizace akrylamidu při přípravě polyakrylamidových gelů pro SDS-PAGE, metodu používanou pro oddělování bílkovin a nukleových kyselin; TEMED obvykle tvoří 0,1 až 0,2 % těchto gelů.
Reference
V tomto článku byl použit překlad textu z článku Tetramethylethylenediamine na anglické Wikipedii.
- ↑ a b c d e f g h i j k N,N,N',N'-Tetramethylethylenediamine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b R. K. Haynes; S. C. Vonwiller; M. R. Vonwiller. Encyclopedia of Reagents for Organic Synthesis. New York: J. Wiley & Sons, 2006. ISBN 0471936235. DOI 10.1002/047084289X.rt064.pub2. Kapitola N,N,N′,N′-Tetramethylethylenediamine.
- ↑ P. M. Morse; G. S. Girolami. Are d0 ML6 Complexes Always Octahedral? The X-ray Structure of Trigonal Prismatic [Li(tmed)]2[ZrMe6]. Journal of the American Chemical Society. 1989, s. 4114–4116.
- ↑ K. W. Henderson; A. E. Dorigo; Q.-L. Liu; P. G. Williard. Effect of Polydentate Donor Molecules on Lithium Hexamethyldisilazide Aggregation: An X-ray Crystallographic and a Combination Semiempirical PM3/Single Point ab Initio Theoretical Study. Journal of the American Chemical Society. 1997, s. 11855.
Externí odkazy
 Obrázky, zvuky či videa k tématu Tetramethylethylendiamin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Tetramethylethylendiamin na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Chemical structure of Tetramethylethylenediamine (TMEDA)
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Ball-and-stick model of the TMEDA molecule









