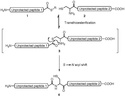
Thioestery

Thioestery jsou organické sloučeniny obsahující funkční skupiny s obecným vzorcem R–S–CO–R', jedná se o analogy karboxylátových esterů, u kterých je atom kyslíku spojující zbytek kyseliny s alkoholovým nahrazen atomem síry. Vznikají esterifikačními reakcemi karboxylových kyselin s thioly. V biochemii jsou významnými zástupci deriváty koenzymu A, například acetyl-CoA.[1]
Příprava
Nejčastěji se thioestery připravují reakcemi acylchloridů s thioláty alkalických kovů:[1]
- RSNa + R′COCl → R′COSR + NaCl
Další často používaný způsob spočívá v odštěpení halogenidů solemi alkalických kovů s thiokarboxylovými kyselinami, například thioacetáty lze získat z thiooctanu draselného:[1]
- CH3COSK + RX → CH3COSR + KX
Obdobná alkylace octanových solí se provádí jen ojediněle. Lze ji provést působením Mannichových zásad na thiokarboxylové kyseliny:
- CH3COSH + R′2NCH2OH → CH3COSCH2NR′2 + H2O
Thioestery mohou být rovněž připraveny kondenzací thiolů a karboxylových kyselin za přítomnosti dehydratačního činidla:[2][3]
- RSH + R′CO2H → RSC(O)R′ + H2O
Obvykle používaným dehydratačním činidlem je zde [N,N'-dicyklohexylkarbodiimid (DCC).[4] Lepší udržitelnosti přípravy a výroby thioesterů bylo dosaženo použitím bezpečnějšího činidla v podobě anhydridu kyseliny propanfosfonové (T3P) a k přírodě šetrnějšího rozpouštědla cyklopentanonu.[5] Acylanhydridy a některé laktony mohou být použity na přípravu thioesterů reakcemi s thioly za přítomnosti zásady.
Thioestery mohou být vytvořeny přeměnou alkoholů Micunobovou reakcí za využití kyseliny thiooctové.[6]
Jinou možností je karbonylace alkynů a alkenů za přítomnosti thiolu.[7]
Reakce
Karbonylová skupina thioesterů je reaktivní vůči nukleofilům, dokonce reaguje i s vodou. Thioestery jsou tak častými meziprodukty přeměn alkylhalogenidů na alkylthioly. Thioestery reagují s aminy za tvorby amidů:
V podobné reakci, využívající „měkký“ kov k zachycení thiolátu, jsou thioestery přeměňovány na estery.[8]
Thioestery poskytují užitečnou chemoselektivitu při syntézách biomolekul.[9]
Reakcí probíhající výhradně u thioesterů je Fukujamovo párování, při němž thioester reaguje organozinečnatým halogenidem za katalýzy palladiem, přičemž se tvoří keton.

Biochemie

Thioestery jsou častými meziprodukty biosyntetických reakcí, jako jsou tvorba a rozklad mastných kyselin a kyseliny mevalonové, sloužící jako prekurzor steroidů. Jako příklady lze uvést malonyl-CoA, acetoacetyl-CoA, propionyl-CoA, cinamoyl-CoA a ACP. Acetogeneze probíhá přes syntézu acetyl-CoA. Do biosyntézy ligninů jsou zapojeny thioesterové deriváty kyseliny kávové.[10]
Tyto thioestery se tvoří podobně jako syntetické, rozdíl spočívá v tom, že dehydratačním činidlem je ATP. Thioestery mají také velký význam při značení bílkovin ubikvitinem, který označuje proteiny určené k degradaci.
Oxidací atomu síry u thioesterů (či thiolaktonů) je součástí bioaktivace léčiv proti srážení krve tiklopidinu, klopidogrelu a prasugrelu.[11][12]
Thionoestery

Thionoestery jsou sloučeniny izomerní s thioestery, atomem síry je zde nahrazen karbonylový kyslík esteru; například methylthionobenzoát má vzorec C6H5C(S)OCH3. Tyto látky se obvykle připravují reakcemi thioacylchloridů s alkoholy.[13]
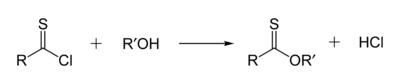
Také mohou být získány reakcí Lawessonova činidla s příslušným esterem nebo Pinnerových solí se sulfanem. Další variantu představuje transesterifikace methylthionoesteru za přítomnosti alkoholu v zásaditém prostředí.[14]

Odkazy
Reference
V tomto článku byl použit překlad textu z článku Thioester na anglické Wikipedii.
- ↑ a b c Matthys J. Janssen "Carboxylic Acids and Esters" in PATAI's Chemistry of Functional Groups: Carboxylic Acids and Esters, Saul Patai, Ed. John Wiley, 1969, New York: pp. 705–764 DOI:10.1002/9780470771099.ch15
- ↑ S. Fujiwara; N. Kambe. Topics in Current Chemistry. Berlin / Heidelberg: Springer, 2005. ISBN 978-3-540-23012-0. DOI 10.1007/b101007. Kapitola Thio-, Seleno-, and Telluro-Carboxylic Acid Esters, s. 87–140.
- ↑ Synthesis of thioesters [online]. Organic Chemistry Portal. Dostupné online.
- ↑ MORI, Y.; SEKI, M. Synthesis of Multifunctionalized Ketones Through the Fukuyama Coupling Reaction Catalyzed by Pearlman's Catalyst: Preparation of Ethyl 6-oxotridecanoate. Org. Synth.. 2007, s. 285. Dostupné online.; Coll. Vol.. S. 281.
- ↑ Andrew Jordan; Helen F. Sneddon. Development of a solvent-reagent selection guide for the formation of thioesters. Green Chemistry. 2019, s. 1900–1906. DOI 10.1039/C9GC00355J.
- ↑ R. Volante. A new, highly efficient method for the conversion of alcohols to thiolesters and thiols. Tetrahedron Letters. 1981, s. 3119–3122. DOI 10.1016/S0040-4039(01)81842-6.
- ↑ Ullmann's Encyclopedia of Industrial Chemistry. Příprava vydání Wiley-VCH. 1. vyd. [s.l.]: Wiley Dostupné online. ISBN 978-3-527-30385-4, ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a05_217.pub2. (anglicky) DOI: 10.1002/14356007.
- ↑ Wan Kit Chan; S. Masamune; Gary O. Spessard. Preparation Of O-esters From The Corresponding Thiol Esters: Tert-butyl Cyclohexanecarboxylate. Organic Syntheses. 1983, s. 48. DOI 10.15227/orgsyn.061.0048.
- ↑ N. A. McGrath; R. T. Raines. Chemoselectivity in chemical biology: Acyl transfer reactions with sulfur and selenium. Accounts of Chemical Research. 2011, s. 752–761. DOI 10.1021/ar200081s. PMID 21639109.
- ↑ A. L. Lehninger; D. L. Nelson; M. M. Cox. Principles of Biochemistry. [s.l.]: Worth Publishing, 2000. Dostupné online. ISBN 1-57259-153-6.
- ↑ D. Mansuy; P. M. Dansette. Sulfenic acids as reactive intermediates in xenobiotic metabolism. Archives of Biochemistry and Biophysics. 2011, s. 174–185. Dostupné online. DOI 10.1016/j.abb.2010.09.015. PMID 20869346.
- ↑ P. M. Dansette; J. Rosi; J. Debernardi; G. Bertho; D. Mansuy. Metabolic Activation of Prasugrel: Nature of the Two Competitive Pathways Resulting in the Opening of Its Thiophene Ring. Chemical Research in Toxicology. 2012, s. 1058–1065. Dostupné online. DOI 10.1021/tx3000279. PMID 22482514.
- ↑ R. J. Cremlyn. An Introduction to Organosulfur Chemistry. [s.l.]: John Wiley and Sons, 1996. Dostupné online. ISBN 0-471-95512-4.
- ↑ J. Josiah; Robert Britton; Chadron M. Friesen. Base-Catalyzed Transesterification of Thionoesters. The Journal of Organic Chemistry. 2018-10-04, s. 12784–12792. Dostupné online. DOI 10.1021/acs.joc.8b02260. PMID 30235418.
Související články
- Thiokarboxylové kyseliny
- Liebeskindova–Šroglova reakce
- 2,2'-dipyridyldisulfid
Externí odkazy
 Obrázky, zvuky či videa k tématu Thioestery na Wikimedia Commons
Obrázky, zvuky či videa k tématu Thioestery na Wikimedia Commons
Média použitá na této stránce
Formation of a thionoester from a thioacyl chloride and an alcohol
Skeletal formula of methyl thionobenzoate
General structure of a thioester
Autor: Starreactor, Licence: CC0
This figure is a reaction scheme for the transesterification of thionoesters
chemical structure of acetyl-CoA made using BKchem