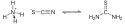Thiokyanatan amonný
| Thiokyanatan amonný | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | thiokyanatan amonný |
| Funkční vzorec | NH4SCN |
| Sumární vzorec | N2H4SC |
| Vzhled | bezbarvá pevná látka[1] |
| Identifikace | |
| Registrační číslo CAS | 1762-95-4 |
| EC-no (EINECS/ELINCS/NLP) | 217-175-6 |
| PubChem | 15666 |
| ChEBI | 30465 |
| SMILES | C(#N)[S-].[NH4+] |
| InChI | 1S/CHNS.H3N/c2-1-3;/h3H;1H3 |
| Vlastnosti | |
| Molární hmotnost | 76,121 g/mol |
| Teplota tání | 149,6 °C (422,8 K)[1] |
| Teplota varu | rozklad[1] |
| Rozpustnost ve vodě | velmi dobře rozpustný[1] |
| Rozpustnost v polárních rozpouštědlech | velmi dobře rozpustný v kapalném amoniaku, oxidu siřičitém a ethanolu, rozpustný v methanolu a acetonitrilu, nerozpustný v chloroformu a ethylacetátu[1] |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H302 H312 H332 H400 H410 H412[1] |
| P-věty | P261 P264 P270 P271 P273 P280 P301+312 P302+352 P304+312 P304+340 P312 P322 P330 P363 P391 P501[1] |
Některá data mohou pocházet z datové položky. | |
Thiokyanatan amonný je anorganická sloučenina se vzorcem NH4SCN, sůl amonného kationtu a thiokyanatanového aniontu.
Příprava a výroba
Thiokyanatan amonný se vyrábí reakcí sirouhlíku s vodným roztokem amoniaku. Meziproduktem je dithiokarbamát amonný, který se zahříváním rozkládá na thiokyanatan amonný a sulfan:
- CS2 + 2 NH3(aq) → NH2C(=S)SNH4 → NH4SCN + H2S
Reakce
Thiokyanatan amonný je na vzduchu stálý; zahříváním se však isomerizuje na thiomočovinu:
Rovnovážná směs obsahuje při 150 °C 30,3 a při 180 °C 25,3 hmotnostních procent thiomočoviny. Zahřátím na 200 °C dojde k rozkladu na amoniak, sulfan, sirouhlík a stopové množství guanidiniumthiokyanátu.
NH4SCN je slabě kyselý; reaguje s hydroxidy alkalických kovů, například sodným nebo draselným, za vzniku thiokyanatanu (sodného nebo draselného), vody a amoniaku. Thiokyanatanový anion reaguje se železitými solemi za vzniku tmavě červeného komplexu:
- 6 SCN− + Fe3+ → [Fe(SCN)6]3−
Thiokyanatan amonný reaguje s ionty několika kovů, například mědi, stříbra, zinku, olova a rtuti, přičemž se sráží příslušné thiokyanatany, které lze extrahovat do organických rozpouštědel.
Použití
Thiokyanatan amonný se používá na výrobu herbicidů, thiomočoviny a průhledných pryskyřic, jako stabilizátor ve fotografii, složka protikorozních přípravků, jako přídavná látka při zpracovávání textilu, k oddělování hafnia od zirkonia a při titračních analýzách.
V roce 1945 bylo navrženo použití thiokyanatanu amonného k omezení úrody rýže v Japonsku v rámci bombardování Japonska.[2]
Thiokyanatan amonný může být také použit ke kolorimetrickému stanovení železa v nápojích.
Dalším možným využitím thiokyanatanu amonného je oddělení chinidinu z likérů po izolaci chininu z neutrálního vodného roztoku síranu. Sůl se přidává k horkému roztoku a vzniklá pevná látka se oddělí od kapaliny a promyje methanolem, který rozpustí většinu nečistot, čímž se vytvoří krystalický thiokyanatan chinidinu o čistotě 90 až 95 %. Následnou separací (obvykle odstřeďováním) lze provést další přečištění do farmaceutické kvality. (Chinidin se používá na léčbu srdeční arytmie.)
Odkazy
Externí odkazy
 Obrázky, zvuky či videa k tématu thiokyanatan amonný na Wikimedia Commons
Obrázky, zvuky či videa k tématu thiokyanatan amonný na Wikimedia Commons - A. F. Wells, Structural Inorganic Chemistry, 5th ed., Oxford University Press, Oxford, UK, 1984. ISBN 978-0198553700
Reference
V tomto článku byl použit překlad textu z článku Ammonium thiocyanate na anglické Wikipedii.
- ↑ a b c d e f g h i Ammonium thiocyanate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ John David Chappell. Before the Bomb: How America Approached the End of the Pacific War. [s.l.]: University Press of Kentucky, 1997. Dostupné online. ISBN 978-0-8131-7052-7. S. 91–92.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Chemical structure of ammonium thiocyanate
Equilibrium between Ammonium thiocyanate and Thiourea