Thiokyanatan
Thiokyanatan (též sulfokyanatan, thiokyanid nebo dříve rhodanid) je funkční skupina odvozená od kyseliny thiokyanaté a tvořící sloučeniny iontové založené na [SCN]− a konjugované zásady). Mezi typické sloučeniny patří bezbarvé soli thiokyanatan draselný a sodný. Jako thiokyanatany se označují také organické sloučeniny obsahující funkční skupinu SCN.
Charakteristika
Thiokyanatan je analogem kyanatanu, [OCN]−, kde je kyslík nahrazen sírou. [SCN]− je jedním z pseudohalogenidů, vzhledem k podobnosti reakcí s těmi, které probíhají u halogenidových iontů. Thiokyanatany se dříve označovaly jako rhodanidy (z řeckého slova pro růži), protože komplexy se železem měly červenou barvu. Thiokyanatany vznikají reakcí elementární síry nebo thiosíranů s kyanidy:
- 8 CN− + S8 → 8 SCN−
- CN− + S2O 2-
3 → SCN− + SO 2-
3 - CN− + S2O 2-
Druhá z reakcí je katalyzována enzymem sulfotransferázou, která je známa též jako rhodanáza a může mít význam při detoxikaci organismu od kyanidů.
Struktura, vazby a koordinační chemie
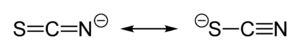
U thiokyanatanu sdílí svůj záporný náboj přibližně rovným dílem síra a dusík. V důsledku toho může thiokyanatan působit jako nukleofil, jak na síře, tak na dusíku – je obouvazným ligandem. [SCN]− může být také můstkem pro dva (M−SCN−M) nebo i tři kovové atomy (>SCN− or −SCN<).
Experimentální důkazy vedou k obecnému závěru, že třída kovů A (tvrdé kyseliny) tvoří N-vazné thiokyanatanové komplexy, kdežto třída B (měkké kyseliny) tvoří S-vazné komplexy. Někdy se projevují i jiné faktory, například kinetika a rozpustnost, může se objevit také vazebný izomerismus, například [Co(NH3)5(NCS)]Cl2 a [Co(NH3)5(SCN)]Cl2.[1]
Organické thiokyanatany
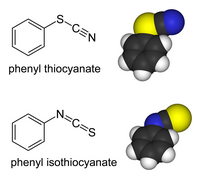
Organické deriváty thiokyanatanů a deriváty s přechodnými kovy mohou existovat jako vazebné izomery. Organická skupina nebo kov se váže na síru: R−S−C≡N má jednoduchou vazbu S-C a trojnou vazbu C-N[2]. V isothiokyanatanech se substituent váže na dusík: R−N=C=S má dvojnou vazbu a C-N taktéž dvojnou vazbu. Organické thiokyanatany se hydrolyzují na thiokarbamáty v Riemschneiderově thiokarbamátové syntéze.
Test na železo Fe3+
Přidá-li se [SCN]− do roztoku obsahujícího železité ionty (Fe3+), zbarví se roztok krvavě červeně, protože se vytvoří ionty [Fe(NCS)(H2O)5]2+.

Výskyt v těle
Málo pravděpodobný se jeví výskyt rhodanidů v lidských slinách. Zde se totiž mohou rhodanidy tvořit, pokud je osoba kuřákem. U nekuřáků se vyskytne pouze tehdy, pohybuje-li se v zakouřeném prostředí. Už jedna vykouřená cigareta je podnětem pro jejich tvorbu. Jako důkaz může posloužit výše popsaná důkazová reakce. U pravidelných kuřáků vznikne rudý komplex, u občasných kuřáků a nekuřáků s pohybem v zakouřených prostředích vzniká oranžový až jemně červený komplex. Nutno dodat, že tvorba v lidských slinách má jisté antibakteriální účinky, a tedy i protektivní účinky na zuby, neboť tak v důsledku sníženého výskytu bakterií v dutině ústní snižuje riziko tvorby zubního kazu.
Reference
V tomto článku byl použit překlad textu z článku Thiocyanate na anglické Wikipedii.
- ↑ GREENWOOD, Norman Neill. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. Dostupné online. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. OCLC 320245801 S. 1396.
- ↑ Guy, R. G. "Syntheses and Preparative Applications of Thiocyanates" in "Chemistry of Cyanates and Their Derivatives," vol II. Patai, S., (Editor), John Wiley, 1977. New York
Externí odkazy
 Obrázky, zvuky či videa k tématu thiokyanatan na Wikimedia Commons
Obrázky, zvuky či videa k tématu thiokyanatan na Wikimedia Commons
Média použitá na této stránce
Pentaaquathiocyanatoiron (II) 3D balls
This image shows some kind of formula that could be converted to TeX. Storing formulas as images makes it harder to change them. TeX also helps making sure that they all use the same font and size.
A replacement has been proposed:
In your article, replace the image with:
<chem>S=C=N^\ominus <->\ ^{\ominus}\!S-C\!\equiv\!N</chem> 


