Thiomočovina
| Thiomočovina | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | thiokarbonyldiamid |
| Ostatní názvy | thiokarbamid |
| Funkční vzorec | CS(NH2)2 |
| Sumární vzorec | CH4N2S |
| Vzhled | bílé krystaly nebo prášek[1] |
| Identifikace | |
| Registrační číslo CAS | 62-56-6 |
| EC-no (EINECS/ELINCS/NLP) | 200-543-5 |
| PubChem | 2723790 |
| SMILES | C(=S)(N)N |
| InChI | InChI=1S/CH4N2S/c2-1(3)4/h(H4,2,3,4) |
| Číslo RTECS | YU2800000 |
| Vlastnosti | |
| Molární hmotnost | 76,121 g/mol |
| Teplota tání | 182 °C (455 K)[1] |
| Teplota varu | rozklad[1] |
| Teplota sublimace | 150 až 160 °C (423 až 433 K) (za nízkého tlaku)[1] |
| Hustota | 1,405 g/cm3[1] |
| Rozpustnost ve vodě | 14,2 g/100 ml[1] |
| Rozpustnost v polárních rozpouštědlech | 11,9 g/100 g (methanol) 3,6 g/100 g (ethanol), rozpustná v roztoku thiokyanatanu amonného[1] |
| Rozpustnost v nepolárních rozpouštědlech | téměř nerozpustná v diethyletheru[1] |
| Tlak páry | 1,88*10−5 Pa[1] |
| Povrchové napětí | 10,404 mN/m (181 C)[1] |
| Termodynamické vlastnosti | |
| Standardní molární spalná entalpie ΔH°sp | −1482,2 kJ/mol (stálý objem) −1485,6 kJ/mol (stálý tlak)[1] |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H302 H351 H361d H411[1] |
| P-věty | P201 P202 P264 P270 P273 P281 P301+312 P308+313 P330 P391 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
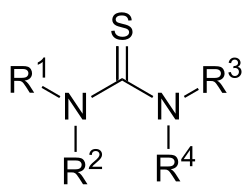
Thiomočovina je organická sloučenina se vzorcem CS(NH2)2. Je strukturně podobná močovině, oproti které má místo kyslíkového atomu síru, jejich vlastnosti jsou však odlišné značně. Thiomočovina se používá jako reaktant v organické syntéze. Jako „thiomočoviny“ se také obecně označují sloučeniny typu (R1R2N)(R3R4N)C=S; thiomočoviny jsou podobné thioamidům (RC(S)NR2), kde R je organická funkční skupina.
Struktura
Molekula thiomočoviny je rovinná. Vazba C=S má délku 171 pm a průměrná délka vazeb C-N činí 133 pm.[2]
Zeslabení vazby C-S bond C-N pí vazbou naznačuje menší délka vazby C=S u thiobenzofenonu (163 pm).
Thiomočovina má dva tautomery, přičemž ve vodných roztocích převažuje thionová forma; rovnovážná konstanta Keq je podle výpočtů 0,001 04.[3]
Thiolová forma, také nazývaná isothiomočovina, vytváří deriváty jako jsou například isothiouroniové soli.
Výroba
Ročně se vyrobí kolem 10 000 tun thiomočoviny. Thiomočovinu lze získat z thiokyanatanu amonného, častěji se ovšem vyrábí reakcí sulfanu s kyanamidem vápenatým za přítomnosti oxidu uhličitého.[4]
Použití
Prekurzor thioxosloučenin
Samotná thiomočovina nemá mnoho využití. Nejčastěji se používá jako prekurzor dioxidu thiomočoviny, používaného jako redukční činidlo v textilním průmyslu.[4]
Hnojivo
Thiomočovina může být použita jako hnojivo, obzvláště v případech environmentálního stresu.[5]
Ostatní použití
Thiomočovina se také používá na výrobu pryskyřičných zpomalovačů hoření a urychlovačů vulkanizace.
Thiomočovina je také složkou diazopapírů a fotografických papírů citlivých na světlo.
Thiomočovina je také látkou využívanou při některých pokovovacích metodách.[6]
Je základní složkou některých čistidel barevných kovů. Například Aurex ji obsahuje až z 15 %.
Reakce
Thiomočovina se při zahřátí nad 130 °C mění na thiokyanatan amonný. Při ochlazení dochází k přeměně amonné soli zpět na thiomočovinu.
Reduční činidlo
Thiomočovina redukuje peroxidy na odpovídající dioly.[7]
Meziproduktem je nestabilní endoperoxid.
Thiomočovinu lze také zapojit do redukční ozonolýzy vytvářející karbonylové sloučeniny.[8]
Při této reakci je možné použít také dimethylsulfid, který je však velmi těkavý (teplota varu 37 °C) a má nepříjemný zápach, zatímco thiomočovina je bez zápachu a netěkavá (díky své polaritě).
Zdroj sulfidových iontů
Thiomočovina může být použita jako zdroj sulfidových iontů, například při přeměně halogenalkanů na thioly. Reakce využívá vysokou nukleofilitu sirného centra a snadné hydrolýzy izothiouroniové soli:
- CS(NH2)2 + RX → RSC(NH2) +
2 X−- RSC(NH2) +
2 X− + 2 NaOH → RSNa + OC(NH2)2 + NaX + H2O - RSC(NH2) +
- RSNa + HCl → RSH + NaCl
V následujícím případě vzniká z 1,2-dibromethanu ethan-1,2-dithiol:[9]
- C2H4Br2 + 2 SC(NH2)2 → [C2H4(SC(NH2)2)2]Br2
- [C2H4(SC(NH2)2)2]Br2 + 2 KOH → C2H4(SH)2 + 2 OC(NH2)2 + 2 KBr
Podobně jako ostatní thioamidy může být thiomočovina použita jako zdroj sulfidových iontů pomocí reakce s kovovými ionty; například její reakcí s rtuťnatými solemi se tvoří sulfid rtuťnatý:
- Hg2+ + SC(NH2)2 + H2O → HgS + OC(NH2)2 + 2 H+
Tyto sulfidační reakce, tedy přípravy sulfidů kovů, vyžadují vodní prostředí a obvykle také zahřívání reakční směsi.[10][11]
Příprava heterocyklů
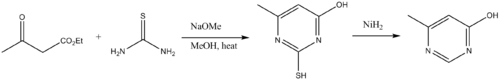
Thiomočoviny jsou stavebními prvky pyrimidinových derivátů. Kondenzují s β-dikarbonylovými sloučeninami.[12] Aminová skupina thiomočoviny kondenzuje s karbonylem, poté dochází k cyklizaci a tautomerizaci. Desulfurizací se poté vytváří pyrimidin.
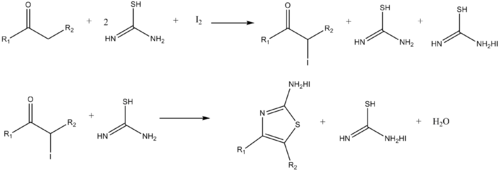
Podobně lze připravit aminothiazoly reakcemi thiomočoviny s α-haloketony.[13]
Z thiomočoviny se vyrábí léčiva kyselina thiobarbiturová a sulfathiazol.[4] 4-Amino-3-hydrazino-5-merkapto-1,2,4-triazol se vyrábí reakcí thiomočoviny s hydrazinem.
Kurnakovova reakce
Thiomočovina je reaktantem při Kurnakovově reakci používané k odlišení cis- a trans- izomerů některých rovinných komplexů platiny. Objevil ji Nikolaj Kurnakov v roce 1893 a stále se používá.[14]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Thiourea na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m n o Thiourea. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ D. Mullen; E. Hellner. A Simple Refinement of Density Distributions of Bonding Electrons. IX. Bond Electron Density Distribution in Thiourea, CS(NH2)2, at 123K. Acta Crystallographica. 1978, s. 2789–2794. doi:10.1107/S0567740878009243.
- ↑ P. E. Allegretti; E. A. Castro; J. J. P. Furlong. Tautomeric equilibrium of amides and related compounds: theoretical and spectral evidences. Journal of Molecular Structure: THEOCHEM. 2000, s. 121–126. doi:10.1016/S0166-1280(99)00294-8.
- ↑ a b c Bernd Mertschenk; Ferdinand Beck; Wolfgang Bauer. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: Wiley-VCH, 2002. ISBN 3527306730. doi:10.1002/14356007.a26_803. Kapitola Thiourea and Thiourea Derivatives.
- ↑ Abdul Wahid. Thiourea: A Molecule with Immense Biological Significance for Plants. International Journal of Agriculture and Biology. 2017-08-01, s. 911–920. Dostupné v archivu pořízeném dne 2020-02-15. ISSN 1560-8530. doi:10.17957/ijab/15.0464.
- ↑ 81st Universal Metal Finishing Guidebook. International Metal Finishing, Guidebook and Directory Issue. 2013, s. 285. Dostupné v archivu pořízeném dne 2017-11-17. ISSN 0026-0576. Archivováno 17. 11. 2017 na Wayback Machine.
- ↑ C. Kaneko; A. Sugimoro; S. Tanaka. A facile one-step synthesis of cis-2-cyclopentene and cis-2-cyclohexene-1,4-diols from the corresponding cyclodienes. Synthesis. 1974, s. 876–877. doi:10.1055/s-1974-23462.
- ↑ D. Gupta; G. Soman; S. Dev. Thiourea, a convenient reagent for the reductive cleavage of olefin ozonolysis products. Tetrahedron. 1982, s. 3013–3018. doi:10.1016/0040-4020(82)80187-7.
- ↑ SPEZIALE, A. J. Ethanedithiol. Org. Synth.. 1963. Dostupné online.; Coll. Vol.. S. 401.
- ↑ An efficient precursor to synthesize various FeS2 nanostructures via a simple hydrothermal synthesis method. CrystEngComm. 2016, s. 6262–6271. doi:10.1039/c6ce01203e.
- ↑ Facile Cd−Thiourea Complex Thermolysis Synthesis of Phase-Controlled CdS Nanocrystals for Photocatalytic Hydrogen Production under Visible Light. The Journal of Physical Chemistry C. 2007, s. 17527–17534. doi:10.1021/jp076566s.
- ↑ FOSTER, H. M., AND SNYDER, H. R. 4-Methyl-6-hydroxypyrimidine. Org. Synth.. 1963. Dostupné online.; Coll. Vol.. S. 638.
- ↑ R. M. Dodson; L. C. King. The reaction of ketones with halogens and thiourea. Journal of the American Chemical Society. 1945, s. 2242–2243. doi:10.1021/ja01228a059. PMID 21005695.
- ↑ George B. Kauffman. Nikolaĭ semenovich kurnakov, the reaction (1893) and the man (1860–1941) a ninety-year retrospective view. Polyhedron. 1983-01-01, s. 855–863. Dostupné online. ISSN 0277-5387. doi:10.1016/S0277-5387(00)81400-X.
Literatura
- The Chemistry of double-bonded functional groups. Redakce Patai S.. New York: John Wiley & Sons, 1977. Dostupné online. ISBN 0-471-92493-8. S. 1355–1496.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu thiomočovina na Wikimedia Commons
Obrázky, zvuky či videa k tématu thiomočovina na Wikimedia Commons - INCHEM assessment of thiourea
- International Chemical Safety Card 0680
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
General chemical structure of the thiourea functional group
Illustration of the tautomers of thiourea
Used ChemDraw
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances